| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《离子方程式的书写及正误判断》试题巩固(2017年最新版)(二)
参考答案:A 本题解析:A.用氨水吸收工业尾气中的SO2时,由于氨水过量,所以产生正盐,:2NH3·H2O+SO2= 2NH4++SO32-+H2O,正确;B. 磁性氧化铁是Fe3O4,应该写化学式,离子方程式是:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O,错误;C.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全时铝元素以AlO2-存在,反应原理错误,离子方程式是:Al3++2SO42-+2Ba2++4OH -= AlO2-+3BaSO4↓+ 2H2O,错误;D.物质的量的关系错误,应该是:2Na2O2+2H2O=4Na++4OH-+O2↑,错误。 本题难度:一般 4、填空题 (16分)重铬酸钠(Na2Cr2O7?2H2O)俗称红矾钠,在工业上有广泛的用途。我国目前主要是以铬铁矿(主要成份为FeO?Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
(1)“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 。 (2)“③”中调节pH至4.7,目的是 。 (3)“⑤”中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式: 。 (4)制取红矾钠后的废水中还含有少量的CrO42-,根据有关标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放。含CrO42-的废水处理可用还原法: CrO42- 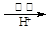 Cr3+ Cr3+ Cr(OH)3。绿矾还原CrO42-的离子方程式为: Cr(OH)3。绿矾还原CrO42-的离子方程式为:。 用该方法处理10 m3 CrO42-的物质的量浓度为1.5×10-3 mol·L-1的废水,至少需要绿矾(FeSO4?7H2O,相对分子质量为278)的质量是 Kg(保留两位小数)。 步骤⑦的操作是 。为进一步得到较为纯净的红矾钠的操作是 参考答案:(1)使反应物接触更充分,加快反应速率,提高原料利用率 本题解析:(1)反应①反应时不断搅拌目的是加快反应速率。 本题难度:困难 5、选择题 下列表示对应化学反应的离子方程式正确的是 ( ) |
参考答案:D
本题解析:A错,Fe3+与I—会发生氧化还原反应;B错,稀硝酸为强氧化性酸能氧化Fe2+离子;C错,正确为:NH4++HCO—3+2OH—=CO2-3+2H2O+NH3;D正确;
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《新型材料》.. | |