微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)NaNO2俗称“工业盐”,其外观与食盐相似,易误食而中毒,可通过化学实验加以鉴别。如向NaNO2的酸性溶液中加入KI固体,析出的碘可以使淀粉溶液变蓝色,据此检验NO2—。
请回答下列问题:
(1)写出上述反应的离子方程式?。
(2)日常生活中若需鉴别工业盐和食盐,现有碘化钾淀粉试纸,则还需选用的生活中常见物质的名称为?。
(3)某工厂废切削液中含有2%—5%的NaNO2,直接排放会造成水污染,但加入下列物质中的某一种就能使NaNO2转化为不引起污染的N2,该物质是?,
a.NaCl? b.H2O2? c.NH4Cl? d.浓H2SO4
所发生反应的离子方程式为:?。
参考答案:(1)2NO2—+2I—+4H+="=2" NO↑+I2+2H2O(3分)
(2)食醋(或醋,答醋酸不得分)(2分)
(3)c(2分)? NH4++ NO2—==N2↑+2H2O (3分)
本题解析:(1)亚硝酸钠具有氧化性,能把碘化钾氧化生成单质碘,其中还原产物是NO,所以方程式为2NO2—+2I—+4H+="=2" NO↑+I2+2H2O
(2)由于亚硝酸钠氧化碘化钾需要在酸性条件下进行,所以还需要生活中的食醋。
(3)亚硝酸钠转化为氮气,说明亚硝酸钠是氧化剂,因此需要加入还原剂,所以应该加入氯化铵,方程式为2NO2—+2I—+4H+="=2" NO↑+I2+2H2O。
本题难度:一般
2、填空题 根据四种基本反应类型,分析下列反应各属于哪种反应类型。
①2KMnO4 K2MnO4+MnO2+O2↑ ②2H2O2
K2MnO4+MnO2+O2↑ ②2H2O2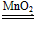 2H2O+O2↑ ③NaCl+AgNO3=AgCl↓+NaNO3
2H2O+O2↑ ③NaCl+AgNO3=AgCl↓+NaNO3
④2Na2O2+2H2O=4NaOH+O2↑ ⑤Zn+H2SO4 =ZnSO4 +H2↑ ⑥2H2+O2 2H2O
2H2O
⑦MnO2+4HCl(浓)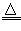 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
置换反应_____(填序号,下同);化合反应______;分解反应_______;复分解反应______。
参考答案:⑤;⑥;①②;③
本题解析:
本题难度:一般
3、填空题 氧化还原滴定与酸碱中和滴定一样是化学实验室常用的定量测定方法。某氧化还 原滴定的反应体系中有反应物和生成物共六种,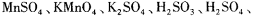
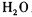 ,其中H2SO3的还原性最强,KMnO4的氧化性最强。对此反应体系:
,其中H2SO3的还原性最强,KMnO4的氧化性最强。对此反应体系:
(1) 被氧化的元素是_______;发生还原反应的过程是________→______。
(2) 请用这六种物质组织一个合理的化学反应,写出它的离子方程式:_______
(3) 反应中H2SO4是_______ (填编号)
A,氧化剂 ?B.氧化产物? C.生成物? D.反应物
(4) 当有20mL 0.1mol/L的氧化剂参加反应时,电子转移数目是_______ 。
(5) 用标准KMnO4溶液滴定H2SO3时,滴定终点时颜色变化是_______。
(6) 滴定过程中.下列图像所表示的关系正确的是_______(填编号)。
参考答案:(11分) (1) +4价的 S(1分);? KMnO4 → MnSO4(2分);
(2)? 2MnO4- +5H2SO3 =2Mn2+ +5SO42- +4H++3H2O(1分);
(3) B、C?(2分);?(4) 0.01NA(或6.02×1021)(2分);
(5)溶液由无色变为紫红色,且半分钟内不变色?(1分);(6) (a)(c) (2分)
本题解析:(1) H2SO3的还原性最强,说明其中的+4价的S元素易被氧化,KMnO4的氧化性最强,说明发生还原反应,故被氧化的元素是+4价的S,发生还原反应的过程是KMnO4 → MnSO4。
(2) H2SO3的还原性最强,反应中做为还原剂,KMnO4的氧化性最强,反应中做为氧化剂,离子方程式为2MnO4- +5H2SO3 =2Mn2+ +5SO 91EXAm.org42- +4H++3H2O。
(3) H2SO4是H2SO3被氧化后生成的产物,故反应中H2SO4是氧化产物,故错BC。
(4)根据离子方程式分析,2molMnO4-转移电子数为10 NA电子,故20mL 0.1mol/L,即0.002mol的氧化剂参加反应时,电子转移数目是0.01NA(或6.02×1021)。
(5)反应过程中,紫红色的KMnO4生成为无色的MnSO4,故用标准KMnO4溶液滴定H2SO3时,滴定终点时颜色变化是溶液由无色变为紫红色,且半分钟内不变色。
(6) 滴定过程中,有酸生成,故pH减小,故(a)正确;反应物H2SO3是弱电解质,部分电离,生成的H2SO4是强电解质,全部电离,离子难度增大,导电性增强,故(b)错误,(c)正确。故选(a)(c)。
点评:本题考查氧化反应的应用和酸碱中和滴定,题目难度中等,注意把握滴定原理以及实验的误差分析,为该题的易错点。
本题难度:困难
4、选择题 已知下列氧化剂都能氧化+4价硫元素,为了除去稀硫酸中混有的少量H2SO3,以得到纯净的稀硫酸,最合理的氧化剂是?
A?KmnO4 B?Ca(ClO)2? C?H2O2 ?D?Cl2?
参考答案:C
本题解析:C 用H2O2作氧化剂不会引入杂质。
本题难度:简单
5、选择题 科学家发现,食用虾类等水生加壳类动物的同时服用维生素C容易中毒。这是因为对人体无害的+5价砷类化合物在维生素C的作用下,能够转化为有毒的+3价的含砷化合物。下列说法中不正确的是
[? ]
A.维生素C具有还原性
B.1mol+5价砷完全转化为+3价砷,共失去2mol电子
C.上述过程中+5价砷元素发生还原反应
D.上述过程中+5价砷类物质作为氧化剂
参考答案:B
本题解析:
试题分析:
选项A,维生素C具有还原性,它可以将+5价砷类化合物还原成+3价的含砷化合物。
选项B,1mol+5价砷完全转化为+3价砷,共得到2mol电子,不是失去电子。
选项C,上述过程中+5价砷元素发生还原反应,化合价降低。
选项D,上述过程中+5价砷类物质作为氧化剂,化合价降低。
故选:B
本题难度:简单