|
高中化学知识点大全《反应速率与平衡的有关计算》考点巩固(2017年最新版)(十)
2017-08-10 01:08:05
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)某温度下,在2L密闭容器中,3种气态物质 X、Y、Z的物质的量随时间变化曲线如图,
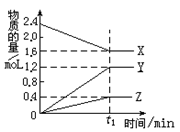
⑴① 该反应的化学方程式是_____________________。
②在t1min时,该反应达到了__________状态,下列可作为判断反应已达到该状态的是__________
A.X、Y、Z的反应速率相等
B.X、Y的反应速率比为2:3
C.容器内气体压强保持不变
D.生成1molZ的同时生成2molX
| ⑵ ①若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1mol氨气分解成氮气和氢气要吸收46kJ的热量,则该反应的热化学反应方程式为:__________________________。
②两位同学讨论放热反应和吸热反应。甲说加热后才能发生的化学反应是吸热反应,乙说反应中要持续加热才能进行的反应是吸热反应。你认为他们说法正确的是______同学。
参考答案:(8分)⑴① 2X  ?3Y + Z?。② 平衡,? CD?。 ?3Y + Z?。② 平衡,? CD?。
⑵ ① 2NH3(g)? ?N2(g) + 3H2(g)?△H=+92KJ/mol。②?乙 ?N2(g) + 3H2(g)?△H=+92KJ/mol。②?乙
本题解析:(1)①从图像可看出从反应开始到平衡状态,X、Y、Z的△n分别为:0.8mol、1.2mol、0.4mol,所以该反应的化学方程式是2X  ?3Y + Z ?3Y + Z
②本反应是一个恒容的、气体系数改变的可逆反应,所以压强是个变量,它保持不变时即为平衡状态;另D项生成Z与生成X恰好分别表示正、逆反应速率,且符合两物质的系数比,能表明正逆反应速率相等,即达到平衡状态。而AB两项不能表明正逆反应速率相等。
(2)①注意方程式系数与反应热的对应关系
②加热是反应的条件,与反应是否为吸热反应没有本质上的联系,故甲错。但如果需要持续加热,那可以肯定反应体系需要吸收能量,是吸热反应
本题难度:一般
2、选择题 将1体积A气体和3体积B气体混合,发生如下反应并达到平衡:2A(g) + B(g)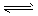 2C(g),在同温同压下测得在反应前后混合气体的密度之比为9∶10,则A的转化率为 2C(g),在同温同压下测得在反应前后混合气体的密度之比为9∶10,则A的转化率为
[? ]
A. 90%
B. 80%
C. 45%
D. 10%
参考答案:B
本题解析:
本题难度:一般
3、选择题 已知某指定反应物(A)的平衡转化率(α)的数学表达式可用下式表示:

下列各项叙述中,表明平衡肯定发生移动的是?(?)
A、反应混合物的浓度改变? B、反应混合物的压强改变
C、正、逆反应速率改变? D、反应物的转化率改变
参考答案:D
本题解析:只要反应过程中正反应速率和逆反应速率不相等,则平衡就一定发生移动。根据转化率的概念可知,如果转化率发生变化,则平衡一定发生了变化,D正确。ABC都是不一定的,答案选D。
本题难度:一般
4、选择题 对于反应2X(g)+Y(g) 2Z(g)不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)和反应时间t的关系如下图所示,下列判断正确的是(? ) 2Z(g)不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)和反应时间t的关系如下图所示,下列判断正确的是(? )
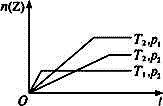
A.T1<T2,p1<p2,正反应为放热反应
B.T1<T2,p1>p2,正反应为吸热反应
C.T1>T2,p1>p2,正反应为放热反应
D.T1>T2,p1<p2,正反应为吸热反应
参考答案:C
本题解析:本题主要考查温度和压强对反应速率和化学平衡的影响。在相同压强(p2)下,温度越高,化学反应速率越快,达平衡时所需时间越短,故T1>T2;在相同温度(T2)下,压强越大,化学反应速率越快,达平衡时所需时间越短,故p1>p2。由于温度升高,平衡向吸热反应方向移动,由图不难看出正反应为放热反应。
本题难度:一般
5、计算题 (8分)将等物质的量的A、B混合于1 L的密闭容器中,发生如下反应
3A(g)+B(g)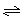 ?xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求: ?xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
(1)此时A的浓度c(A)=________mol/L,反应开始前容器中的A、B的物质的量:n(A)=n(B)=________mol。
(2)B的平均反应速率v(B)=________mol/(L·min)。?
(3)x的值为________。
参考答案:(1)0.75,1.5? (2)0.05? (3) 2?(每空2分)
本题解析:考查可逆反应的有关计算。
(1)C的平均反应速率是0.1mol/(L·min),则C的浓度是0.5mol/L,所以根据变化量之比是相应的化学计量数之比可知x=2。又因为反应速率之比是相应的化学计量数之比,所以B的反应速率是0.1mol/(L·min)÷2=0.05mol/(L·min)。
(2)? 3A(g)+B(g)  2C(g)+2D(g) 2C(g)+2D(g)
起始量(mol)? n? n? 0? 0
转化量(mol)? 0.5? 0.25? 0.5? 0.5
平衡量(mol)? n-0.75? n-0.25? 0.5? 0.5
所以有(n-0.75)︰(n-0.25)= 3:5
解得n=1.5mol,所以A的浓度是0.75mol÷1L=0.75mol/L
本题难度:一般
|