微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 现有五种1~20号元素组成A~I纯净物(试剂X除外),转化关系如下
相关信息有;①反应④产生白色沉淀,且M(H):143.5g/mol;
②常温下,A、I都是气态单质,且A和I的一种同素异形体都能使湿润的有色布条褪色且都能用于饮用水消毒.
③1molB含28mole-,反应③属于分解反应.
④C是由第三周期的两种元素组成原子个数比为1:3型化合物.
(1)B的电子式为______.试剂X的名称为______.反应②离子方程式:______.
(2)写出反应③的化学方程式:______;上述所有物质形成的晶体类型有______?(选填:分子晶体、离子晶体、原子晶体)
(3)C溶液中阴离子浓度与阳离子浓度之比______3(填:大于、小于或等于);简述实验室用C晶体配制3mol/L的C溶液的操作方法是______.
(4)写出G与C溶液混合的离子方程式______.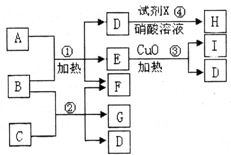
参考答案:反应④产生白色沉淀,且M(H)为143.5g/mol,可知H为AgCl,故D含有Cl元素且溶于水电离出Cl-,试剂X为硝酸银溶液;
常温下,A、I都是气态单质,且A和I的一种同素异形体都能使湿润的有色布条褪色且都能用于饮用水消毒,所以A为Cl2,I为O2;
反应③属于分解反应生成氧气与D,CuO起催化剂作用,反应生成的D含有Cl元素且溶于水电离出Cl-,故E为KClO3,D为KCl,反应①Cl2+B→KCl+KClO3+F,氯气发生歧化反应,考虑氯气与碱的反应,B含有K元素,1molB含28mole-,故B为KOH,F为H2O;
由反应②KOH+C→H2O+G+KCl,故C含有Cl元素,C是由第三周期的两种元素组成原子个数比为1:3型化合物,故C为AlCl3,G为KAlO2;
(1)由上述分析可知,B为KOH,由钾离子与氢氧根离子构成,电子式为:

;试剂X为硝酸银溶液;
反应②是过量氢氧化钾与氯化铝反应生成氯化钾、偏铝酸钾、水,反应离子方程式为:4OH-+Al3+=AlO2-+2H2O,
故答案为:

;硝酸银溶液;4OH-+Al3+=AlO2-+2H2O;
(2)反应③是氯酸钾在催化剂、加热的条件下分解生成氯化钾与氧气,反应方程式为:2KClO3??CuO?.△2KCl+3O2↑;
上述所有物质中形成的晶体类型有:分子晶体、离子晶体;
故答案为:2KClO3??CuO?.△2KCl+3O2↑;分子晶体、离子晶体;
(3)AlCl3溶液中Al3+离子水解,Cl-与 Al3+浓度之比大于3,为防止水解,配制氯化铝溶液通常加入盐酸,实验室用AlCl3晶体配制3mol/L的AlCl3溶液的操作方法是:取一定量氯化铝晶体溶于一定量较浓的盐酸中,加蒸馏水稀释至3mol/L的氯化铝溶液,
故答案为:大于;取一定量氯化铝晶体溶于一定量较浓的盐酸中,加蒸馏水稀释至3mol/L的氯化铝溶液;
(4)G与C溶液混合反应是偏铝酸钾与氯化铝反应生成氢氧化铝与氯化钾,反应离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓.
本题解析:
本题难度:一般
2、填空题 (9分)水是生命之源,也是化学反应中的主角。试回答下列问题:
A.B.C是中学化学常见的三种有色物质(其组成的元素均属短周期元素),
它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,请写出
A.B.C与水反应的化学方程式:
(1) _____ ______?_
(2) ?
(3) ?。
参考答案:

本题解析:略
本题难度:一般
3、简答题 有①~⑧八种短周期元素,其原子序数依次增大,其中②、⑦、⑧三种元素在周期表中的相对位置如下,且元素②所处主族的位置为所有主族的正中间.
(1)元素②在周期表中的位置为______周期______族;②、⑦、⑧三种元素的原子半径由小到大的顺序是______(用元素符号表示).②、⑦、⑧三种元素最高价氧化物对应水化物的酸性由强到弱的顺序是______(用化学式表示).
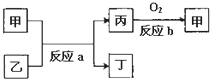
(2)如图所示,甲、乙、丙、丁均为①~⑧中某些元素形成的单质或化合物,反应a为置换反应,反应b为化合反应(反应条件已略去),单质乙与单质丙所含元素位于同一主族,任写一个符合条件的反应a的化学方程式:______.
参考答案:(1)元素②所处主族的位置为所有主族的正中间,应为ⅣA族元素,由在周期表中的位置可知应为C,则⑦为S元素,⑧为Cl元素,
由此可知元素②位于周期表第二周期第IVA族,元素周期表中,同周期元素从左到右原子半径逐渐减小,同主族元素从上到下逐渐增大,则原子半径C<Cl<S,非金属性
C<S<Cl,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则为HClO4>H2SO4>H2CO3,
故答案为:二;IVA;C<Cl<S;HClO4>H2SO4>H2CO3;
(2)单质乙与单质丙所含元素位于同一主族,且反应为置换反应,由反应b可知甲为氧化物,应为单质和氧化物之间的置换反应,常见有Na+H2O→NaOH+H2,C+SiO2→Si+CO等,反应的方程式为2Na+2H2O=2NaOH+H2↑或2C+SiO2高温.Si+2CO↑,
故答案为:2Na+2H2O=2NaOH+H2↑或2C+SiO2高温.Si+2CO↑.
本题解析:
本题难度:一般
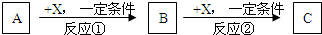
4、填空题 A、B、C、X均为常见的纯净物,它们之间有如下转化关系(副产品已略去).
试回答:
(1)若X是强氧化性单质,则A不可能是______.
a.S?b.N2?c.Na?d.Mg?e.Al
(2)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为______;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示)______.检验此C溶液中金属元素价态的操作方法是______.
(3)若A、B、C为含某金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为______,X的化学式可能为(写出不同类物质)______或______.反应①的离子方程式为______.
参考答案:(1)若X是强氧化性单质,由转化关系AX
本题解析:
本题难度:一般
5、推断题 下图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为Cl2、E为Fe单质,其余为化合物。它们存在如下转化关系,反应中生成的水及次要产物均已略去。

(1)写出有关物质的名称或化学式:B______,F____,H____。
(2)指出MnO2在相关反应中的作用:反应①中是剂,反应②中是____剂。
(3)若反应①是在加热条件下进行,则A是__________;若反应①是在常温条件下进行,则A是__________。
(4)写出B与MnO2共热获得D的化学反应方程式:_____________________。
参考答案:(1)HCl;Fe3O4;FeCl3
(2)催化;氧化
(3)KClO3;H2O2
(4)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
本题解析:
本题难度:一般