微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质间的反应不能产生气体的是
A.Na与H2O
B.Na2O2和H2O
C.Na2O和稀H2SO4
D.NaHCO3和稀H2SO4
参考答案:C
本题解析:
本题难度:困难
2、选择题 某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+.取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀.由此可知原溶液中
A.至少存在5种离子
B.Cl-一定存在,且c(Cl?)≥0.4mol/L
C.SO42-、NH4+、一定存在,Cl-可能不存在
D.CO32-、Al3+一定不存在,K+可能存在
参考答案:B
本题解析:分析:加入过量NaOH溶液,加热,得到0.02mol气体,可知一定存在铵离子;
红褐色沉淀是氢氧化铁,1.6g固体为三氧化二铁,可知一定有Fe3+,一定没有CO32-;
4.66g不溶于盐酸的沉淀,硫酸钡沉淀,物质的量为:0.02mol;
根据以上数据推算存在离子,根据电荷守恒推算氯离子的存在及数据.
解答:由于加入过量NaOH溶液,加热,得到0.02mol气体,说明一定有NH4+,且物质的量为0.02mol;同时产生红褐色沉淀,说明一定有Fe3+,1.6g固体为氧化铁,物质的量为0.01mol,故有0.02molFe3+,一定没有CO32-;
? 4.66g不溶于盐酸的沉淀为硫酸钡,一定有SO42-,物质的量为0.02mol;
? 根据电荷守恒,一定有Cl-,至少 0.02mol×3+0.02-0.02mol×2=0.04mol,物质的量浓度至少 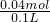 =0.4mol/L,
=0.4mol/L,
A、至少存在Cl-、SO42-、NH4+、Fe3+四种离子,故A错误;
B、根据电荷守恒,至少存在0.04molCl-,故B正确;
C、一定存在氯离子,故C错误;
D、Al3+无法判断是否存在,故D错误;
故选B.
点评:本题考查离子共存知识,做题是认真阅读、分析题中数据,合理分析,特别是氯离子的推断,难度中等.
本题难度:简单
3、选择题 下列物质与氯气反应制得漂白粉的是
A.Na
B.Ca(OH)2
C.H2
D.H2O
参考答案:B
本题解析:漂白粉的有效成分是次氯酸钙,应由氢氧化钙与氯气反应制得。所以正确答案选B。
本题难度:困难
4、选择题 下列对金属及其化合物叙述正确的是
A.Na与Na2O2都可投入水中,生成氢气
B.Al与Al2O3都可溶于NaOH溶液,生成偏铝酸盐
C.Na2O与Al2O3都可溶于水,形成对应的碱NaOH和Al(OH)3
D.Al(OH)3与Fe(OH)3都可以在加热条件下,生成对应的氧化物Al2O3和Fe2O3
参考答案:BD
本题解析:分析:A、根据Na2O2与水反应;
B、根据Al与Al2O3都可与NaOH溶液反应生成偏铝酸盐;
C、根据Al2O3不能与水反应形成对应的碱;
D、根据难溶性碱加热分解得到氧化物的水;
解答:A、因Na2O2与水反应,生成氢氧化钠和氧气,故A错误;
B、因Al与Al2O3都可与NaOH溶液反应生成偏铝酸盐,故B正确;
C、因Al2O3不能与水反应形成对应的碱,故C错误;
D、因难溶性碱加热分解得到氧化物的水,故D正确;
故选:BD.
点评:本题考查学生常见金属元素、氧化物以及难溶性碱的性质,可以根据所学知识来回答,难度不大.
本题难度:一般
5、选择题 将13.7g?Na2CO3与NaHCO3的混合物充分加热,共收集到标准状况下的气体1.12L,则混合物中Na2CO3与NaHCO3的物质的量之比为
A.1:1
B.2:1
C.1:2
D.3:1
参考答案:C
本题解析:分析:固体加热时发生2NaHCO3 Na2CO3+CO2↑+H2O,由充分反应生成的气体可计算混合物中NaHCO3质量,再计算碳酸钠的质量,根据n=
Na2CO3+CO2↑+H2O,由充分反应生成的气体可计算混合物中NaHCO3质量,再计算碳酸钠的质量,根据n= 计算各自的物质的量.
计算各自的物质的量.
解答:令化合物中碳酸氢钠的质量为m,则:
2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
168g? 22.4L
m? 1.12L
所以m=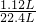 ×168g=8.4g
×168g=8.4g
所以碳酸氢钠的物质的量为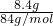 =0.1mol,
=0.1mol,
碳酸钠的质量为13.7g-8.4g=5.3g,物质的量为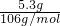 =0.05mol,
=0.05mol,
故混合物中Na2CO3与NaHCO3的物质的量之比为0.05mol:0.1mol=1:2,
故选C.
点评:考查混合物的计算、根据方程式的计算,比较基础,清楚反应过程是解题的关键,加强基础知识的掌握.
本题难度:困难