微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将一小块钠投入下列溶液时,既能产生气体又会出现沉淀的是(?)
A.稀H2SO4
B.氢氧化钠溶液
C.硫酸铜溶液
D.氯化镁溶液
参考答案:CD
本题解析:钠投入到稀硫酸溶液中,钠不仅和稀硫酸反应还和水反应,稀硫酸和钠反应生成物是硫酸钠和氢气;氢氧化钠稀溶液和钠反应,实质是钠与水反应,生成物是氢氧化钠和氢气;硫酸铜溶液和钠反应,可看作钠先和水反应,然后生成的氢氧化钠再和硫酸铜反应,所以产物有蓝色沉淀、气体、硫酸钠;钠和氯化镁溶液反应,可看作钠先和水反应,然后生成的氢氧化钠再和氯化镁反应,所以产物有白色氢氧化镁沉淀、气体、氯化钠,有关反应方程式分别如下:2Na+H2SO4=Na2SO4+H2↑、2Na+2H2O=2NaOH+H2↑、CuSO4+2Na+2H2O=Cu(OH)2↓+Na2SO4+H2↑、MgCl2+2H2O+2Na=Mg(OH)2?↓+2NaCl+H2↑,因此正确的答案选CD。
点评:该题是中等难度的试题,侧重对学生灵活运用基础知识解决实际问题的能力的培养。表面看钠与碱不反应,无方程式可写,但是钠却能够和溶液中的溶剂水反应,所以反应的实质就是钠与水的反应,另一方面还考查了学生的思维能力。
本题难度:一般
2、选择题 向饱和Na2CO3溶液中通入足量CO2,下列说法不正确的是?(?)
A.溶液中有Na2CO3·10H?2O晶体析出
B.溶液的pH减小
C.溶液中发生的离子反应为:CO2+H2O+CO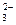 ===2HCO
===2HCO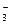
D.溶液中Na+的物质的量减少
参考答案:A
本题解析:略
本题难度:简单
3、选择题 有15g Na2O2、Na2O、NaOH的混合物与400 g质量分数为3.65%的盐酸恰好反应,蒸干溶液,最终得固体质量为
A.23.4 g
B.25.5g
C.31 g
D.无法计算
参考答案:A
本题解析:最终得到的固体是氯化钠,所以根据氯原子守恒可知,氯化钠的物质的量是400×3.65%÷36.5=0.4mol,所以氯化钠的质量是0.4mol×58.5g/mol=23.4g,答案选A。
本题难度:一般
4、选择题 将铷和另一碱金属组成的混合物4.6 g与水反应,生成了0.2 g氢气,则另一碱金属可能是(?)
A.锂
B.钠
C.铯
D.以上三种都有可能
参考答案:A
本题解析:假设4.6 g全部是铷,生成的氢气小于0.2 g,由此可知另一碱金属若为4.6 g,生成的氢气质量一定大于0.2 g,设另一碱金属的相对原子质量为Ar,则
2M+2H2O====2MOH+H2↑
2Ar? 2
4.6 g?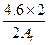 g>0.2 g
g>0.2 g
所以Ar<23,一定是锂。
本题难度:简单
5、填空题 工业生产纯碱的工艺流程示意图如下:

完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式A.??,B.?
(2)实验室提纯粗盐的实验操作依次为:取样、?、沉淀、?、?、冷却结晶、?、烘干
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是?.碳酸化时没有析出碳酸钠晶体,其原因是?
(4)碳酸化后过滤、滤液D最主要的成分是??(填写化学式),检验这一成分的阴离子的具体方法是?
(5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨.加石灰水后所发生的反应的离子方式程为?,滤液D加石灰水前先要加热,原因是??
(6)产品纯碱中含有碳酸氢钠.如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为?(注明你的表达式中所用的有关符号的含义)
参考答案:(1)Ca(OH)2或CaO? Na2CO3
(2)溶解?过滤?蒸发?过滤
(3)有晶体析出(或出现浑浊)?碳酸钠溶解度比碳酸氢钠大
(4)NH4Cl ?取样,加硝酸酸化,再加入硝酸银溶液,有白色沉淀产生,证明该阴离子是氯离子
(5)NH4++OH-=NH3↑+H2O?防止加石灰水时产生碳酸钙沉淀
(6)w(NaHCO3)=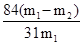 ?(设加热前质量为m1,加热后m2 )
?(设加热前质量为m1,加热后m2 )
本题解析:(1)粗盐水中含有Mg2+ 、Ca2+ 、用Ca(OH)2或CaO将Mg2+ 转化为Mg(OH)2 ,再用Na2CO3将Ca2+ 转化为CaCO3沉淀,答案:Ca(OH)2或CaO? Na2CO3
⑵实验室提纯粗盐的整个操作过程为:取样、溶解、沉淀、过滤、蒸发、冷却结晶、过滤、烘干几步;答案为:溶解?过滤?蒸发?过滤
(3)纯碱生产中碳酸化时,会看到溶液中析出晶体,这是由于碳酸钠的溶解度大于碳酸氢钠,故答案为:碳酸钠溶解度比碳酸氢钠大;
(4)根据操作过程,氨化后通入二氧化碳的溶液发生复分解反应:H2O+CO2+NH3+NaCl=NaHCO3+NH4Cl,最终得到NH4Cl还有NaHCO3等,碳酸氢钠溶解度很小而结晶,故酸化后滤液的主要成分为:NH4Cl;检验其中的Cl―离子时,要经过取样,加硝酸酸化,加硝酸银,有白色沉淀,该阴离子是氯离子,答案:NH4Cl?取样,加硝酸酸化,再加入硝酸银溶液,有白色沉淀产生,证明该阴离子是氯离子。
(5)滤液中主要含有的是氯化铵,其和石灰水反应时:NH4++OH- NH3↑+H2O,滤液D加石灰水前先要加热,原因是防止加石灰水时产生碳酸钙沉淀,答案为:NH4++OH-
NH3↑+H2O,滤液D加石灰水前先要加热,原因是防止加石灰水时产生碳酸钙沉淀,答案为:NH4++OH- NH3↑+H2O,防止加石灰水时产生碳酸钙沉淀
NH3↑+H2O,防止加石灰水时产生碳酸钙沉淀
(6)假设加热前纯碱的质量为m1,加热后的质量为m2,则加热损失的质量为:m1-m2,则纯碱中碳酸氢钠的质量为: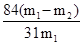 ;故纯碱中含有的碳酸氢钠的质量分数为=
;故纯碱中含有的碳酸氢钠的质量分数为=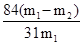 ,答案为:w(NaHCO3)=
,答案为:w(NaHCO3)=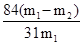 ?(设加热前质量为m1,加热后m2 )
?(设加热前质量为m1,加热后m2 )
本题难度:一般