微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 用下图装置能达到粗铜精炼的目的。
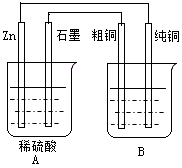
(1)A烧杯是__________(填〝电解池〞或〝原电池〞),B烧杯是___________(填〝电解池〞或〝原电池〞)。
(2)其中B烧杯中应该盛_________溶液。
(3)分别写出石墨棒和纯铜棒的电极反应式石墨棒:_________________,纯铜棒:_______________。
(4)若锌减少了0.65g,则纯Cu的质量增加了多少克?(写出计算过程)
参考答案:(1)原电池;电解池
(2)硫酸铜(或其它合理铜盐)
(3)2H++2e-==H2↑;Cu2++2e-==Cu
(4)0.64g
本题解析:
本题难度:一般
2、选择题 下列金属中,通常用电解法冶炼的是( )
A.钠
B.铁
C.铜
D.银
参考答案:A
本题解析:
本题难度:一般
3、填空题 铜在自然界存在于多种矿石中,如:
| 矿石名称 | 黄铜矿 | 斑铜矿 | 辉铜矿 | 孔雀石
主要成分
CuFeS2
Cu5FeS4
Cu2S
CuCO3?Cu(OH)2
|
①上表所列铜化合物中,铜的质量百分含量最高的是______.
②工业上以黄铜矿为原料.采用火法溶炼工艺生产铜.该工艺的中间过程会发生反应:2Cu2O+Cu2S6Cu+SO2↑,反应的氧化剂是______.
③SO2尾气直接排放到大气中造成环境污染的后果是______;处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称______.
④黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制.请简述粗铜电解得到精铜的原理:______.
⑤下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是______(填字母).
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断
A
铜绿的主成分是碱酸铜
可用稀盐酸除铜器表面的铜绿
Ⅰ对;Ⅱ对;有
B
铜表易形成致密的氧化膜
铜容器可以盛放浓硫酸
Ⅰ对;Ⅱ对;有
C
铁比铜活泼
例在铜板上的铁钉在潮湿空气中不易生锈
Ⅰ对;Ⅱ对;有
D
蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化
硫酸铜溶液可用作游泳池的消毒剂
Ⅰ错;Ⅱ对;无
参考答案:(1)铜化合物中,铜的质量百分含量=铜的原子量×原子个数分子量×100%,
黄铜矿中铜的含量=6464+56+32×2×100%=35%;
斑铜矿中铜的含量=64×564×5+56+32×4×100%=63%;
辉铜矿中铜的含量=64×264×2+32×100%=80%;
孔雀石中铜的含量=64×264×2+12+16×5+1×2×100%=58%
所以铜的质量百分含量最高的是Cu2S.
故答案为:Cu2S.
(2)2Cu2O+Cu2S?高温?.?6Cu+SO2↑,该反应中铜的化合价由+1价变为0价,铜元素在该反应中得电子化合价降低,所以该反应中的氧化剂是Cu2O,Cu2S.
故答案为:Cu2O,Cu2S.
(3)二氧化硫是有毒气体,二氧化硫溶于水后形成酸性溶液,随雨水降下,就可能形成酸雨;二氧化硫能溶于水,且能和水反应生成亚硫酸,亚硫酸能被氧化成硫酸,二氧化硫是酸性氧化物,所以能用碱液吸收生成盐,如硫酸铵.
故答案为:二氧化硫是有毒气体,二氧化硫溶于水后形成酸性溶液,随雨水降下,就可能形成酸雨;硫酸,硫酸铵.
(4)粗铜电解得到精铜的原理:电解池中,粗铜作阳极,精铜作阴极,电解质为硫酸铜溶液.阳极上发生氧化反应,Cu失去电子,使Cu单质变为Cu 2+进入溶液中Cu-e-═Cu 2+;阴极上发生还原反应,Cu 2+得到电子在阴极上析出Cu单质,Cu 2++e-═Cu,从而达到精制Cu的目的.
故答案为:粗铜电解得到精铜的原理:电解池中,粗铜作阳极,精铜作阴极,电解质为硫酸铜溶液.阳极上发生氧化反应,Cu失去电子,使Cu单质变为Cu 2+进入溶液中Cu-e-═Cu 2+;阴极上发生还原反应,Cu 2+得到电子在阴极上析出Cu单质,Cu 2++e-═Cu,从而达到精制Cu的目的.
(5)A、Ⅰ铜绿的主成分是碱式碳酸铜,故正确;Ⅱ碱式碳酸铜能和强酸反应生成盐和水、二氧化碳,故正确;碱式碳酸铜是弱酸盐能和强酸反应,所以二者有因果关系,故A正确.
B、Ⅰ铜是不活泼金属,所以其表面不易形成致密的氧化膜,故错误;Ⅱ常温下,铜和浓硫酸不反应,所以铜容器可以盛放浓硫酸,故正确;二者没有、因果关系,所以B错误.
C、Ⅰ铁的金属性比铜的金属性强,所以铁比铜活泼,故正确;Ⅱ在铜板上的铁钉在潮湿空气中易形成原电池,所以易生锈,故错误;二者有因果关系,所以C错误.
D、Ⅰ蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是化学变化,故错误;硫酸铜是重金属盐,能使蛋白质变性,所以溶液可用作游泳池的消毒剂,故正确;二者没有因果关系,所以D正确.
故选AD.
本题解析:
本题难度:简单
4、选择题 工业上,金属钠的制备方法是( )
A.电解氯化钠溶液
B.电解熔融的氯化钠
C.从自然界直接开采金属钠
D.煅烧氯化钠固体
参考答案:B
本题解析:
本题难度:简单
5、选择题 Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池如图所示,电解总反应:
2Cu+H2O  Cu2O+H2↑。下列说法正确的是 Cu2O+H2↑。下列说法正确的是
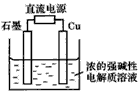
[? ]
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1mol电子转移时,有0.1molCu2O生成
参考答案:A
本题解析:
本题难度:一般
|