微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列金属冶炼的反应原理,错误的是( )
A.2NaCl(熔融)
2Na+Cl2↑
B.MgO+H2Mg+H2O
C.Fe2O3+3CO2Fe+3CO2
D.2HgO2Hg+O2↑
参考答案:B
本题解析:
本题难度:一般
2、简答题 火法炼锌是将闪锌矿(主要含ZnS)焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1100-1300℃,使锌蒸馏出来(设空气中N2、02的体积分数分别为0.8、0.2).主要反应为:
焙烧炉中:2ZnS(s)+3O2→2ZnO(s)+2SO2?(g)?①
鼓风炉中:2C(s)+O2?(g)→2C0(g)?②
鼓风炉中:ZnO(s)+CO(g)?Zn(g)+CO2(g)?③
(1)ZnS质量分数为62%的闪锌矿(杂质不含锌)锌的质量分数为______%(保留小数点后一位数字).
(2)焙烧炉产生的炉气中SO2的体积分数不超过______%(保留小数点后一位数字).
(3)鼓风炉容积固定,炉内部分气态物质物质的量浓度(mol/L)变化如下:
| ?时间/min | ?C0 | ?Zn | ?CO2
?0
?0.11
?0
?0
?2
?0.1
?0.01
?0.01
?3
?0.01
?0.1
?0.1
?4
?0.01
?0.1
?0.1
|
则鼓风炉中C0的总转化率为______;若生产中C0的总利用率为98%,则每生产1mol?Zn至少需补充焦炭______g.
(4)若ZnS全部转化为Zn.焙烧炉出来的N2、O2、SO2的混合气体中N2占82.5%,鼓风炉中C0的转化率为62.5%,而O2无剩余.则每生产1molZn,应向焙烧炉和鼓风炉中鼓入新鲜空气共为______L(STP).
参考答案:(1)ZnS中锌的质量分数ω(Zn)=6565+32=6597
闪锌矿中锌的质量分数为62%×ω(Zn)=62%×6597=41.5%
故答案为:41.5
(2)假定有2molZnS,最少通入3molO2,根据方程式2ZnS(s)+3O2→2ZnO(s)+2SO2?(g)?可知,生成的SO2的物质的量为2mol;未参加反应的N2的物质的量为3mol×4=12mol.此时SO2的体积分数为2mol2mol+14mol×100%=14.3%.实际通入的空气要多,故SO2的体积分数不超过14.3%.
故答案为:14.3
(3)由表可知,3min时,反应达平衡,此时C0的平衡浓度为0.01mol/L,
所以C0的总转化率为0.11mol/L-0.01mol/L0.11mol/L×100%=90.9%.
令需焦炭质量为mg,实际利用的为89%mg,由方程式可得,关系式ZnO(s)~C(s),所以n(ZnO)=n(C),
即89%mg12g/mol=1,解得m=12.25
故答案为:90.9%;12.25
(4)设焙烧炉中消耗空气的物质的量为5x,鼓风炉中消耗空气物质的量为5y
则:2C+O2=2CO; ZnO(s)+CO(g)=Zn(g)+CO2(g).
? y? 2y? 2y×62.5%? 1mol
?所以2y×62.5%=1mol?
解得 y=0.8mol,所以 5y=4mol
? 2ZnS+3O2=2ZnO+2SO2 △n,
?2mol?1mol
?1mol? 0.5mol
所以4x/(5x-0.5mol)=82.5%?
解得? x=3.3mol,所以 5x=16.5mol
所以5x+5y=4mol+16.5mol=20.5mol
V(空气)=20.5mol×22.4L?mol-1=459.2L
故答案为:459.2L
本题解析:
本题难度:一般
3、选择题 下列金属的冶炼中,通常是用加热分解的方法来完成的是( )
A.Na
B.Mg
C.A1
D.Ag
参考答案:D
本题解析:
本题难度:简单
4、选择题 下列说法正确的是( )
A.在“镀锌铁皮的镀层厚度的测定”实验中,将镀锌铁皮放入稀硫酸,待产生氢气的速率突然减小,可以判断锌镀层已反应完全
B.在“火柴头中氯元素的检验”实验中,摘下几根未燃过的火柴头,将其浸于水中,稍后取少量溶液于试管中,滴加硝酸银溶液和稀硝酸后,即可判断氯元素的存在
C.在“硫酸亚铁铵的制备”实验中,为了得到硫酸亚铁铵晶体,应小火加热蒸发皿,直到有大量晶体析出时停止加热
D.受强酸或强碱腐蚀致伤时,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理
参考答案:A
本题解析:
本题难度:简单
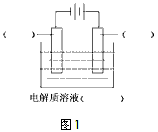
5、填空题 高纯铜(纯度可达99.99%)广泛应用于电器工业。某粗铜样品中含Fe、Ni、Ag、Au等四种金属杂质,可用电解法进行精炼制得高纯铜。
(1)请在下图1中标明电极材料和电解质溶液的名称

(2)已知Ni的金属活动性介于Fe和Sn之间。则精炼完成后,在阳极底部的沉积物中可回收到的金属为
__________(填化学式)。
(3)若在实验室中完成此实验,可用铅蓄电池做电源。铅蓄电池的电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O,在完全放电耗尽PbO2和Pb时,若按上图2所示连接进行充电,充电一段时间后,则在A电极上生成__________(填化学式),B电极上生成________(填化学式);充电完毕,铅蓄电池的正极是________极(填“A”或“B”)
2PbSO4+2H2O,在完全放电耗尽PbO2和Pb时,若按上图2所示连接进行充电,充电一段时间后,则在A电极上生成__________(填化学式),B电极上生成________(填化学式);充电完毕,铅蓄电池的正极是________极(填“A”或“B”)
(4)电解完毕后,某兴趣小组欲对电解液中的离子进行分离,他们通过查阅资料,得知相关氢氧化物在不同pH下的溶解度曲线如图。

①结合上图分析,相同温度下Ksp[Cu(OH)2]、Ksp[Ni(OH)2]、Ksp[Fe(OH)2]由大到小的顺序为__________________________
②分离过程中,使上述溶液的pH逐渐增加,则溶液中的Cu2+、Fe3+和Ni2+沉淀的先后顺序依次为____________________。
参考答案:(1)左:精铜;右:粗铜;电解质为:硫酸铜溶液
(2)Ag、Au
(3)Pb;PbO2;B
(4)①Ksp[Fe(OH)2]>Ksp[Ni(OH)2]>Ksp[Cu(OH)2];②Fe3+、Cu2+、Fe2+
本题解析:
本题难度:困难