微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 X元素的阳离子和Y元素的阴离子具有相同的电子层结构,下列叙述正确的是
A.原子序数:XB.原子半径:XC.离子半径:X>Y
D.电负性:X
参考答案:D
本题解析:具有相同电子层结构的离子,阳离子对应的原子比阴离子对应的原子多一个电子层。所以X原子序数比Y的大,原子半径比Y的大,离子半径比Y的小。X为金属元素,Y为非金属元素,电负性X<Y,D正确。
本题难度:困难
2、选择题 几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | L | M | X | R | T
原子半径/nm
0.160
0.143
0.102
0.089
0.074
主要化合价
+2
+3
+6,-2
+2
-2
|
下列叙述错误的是( )
A.R的氧化物对应的水化物可能具有两性
B.X单质在氧气中燃烧不可能生成XO3
C.离子半径大小:r(M3+)<r(T2-)
D.L2+和X2-的电子层结构相同
参考答案:L和R的化合价都为+2价,应为周期表第ⅡA族,根据半径关系可知R为Be,L为Mg,X和T的化合价都有-2价,应为周期表第ⅥA族元素,X的最高价为+6价,应为S元素,T无正价,应为O元素,M的化合价为+3价,应为周期表第ⅢA族元素,根据半径大于R小于L可知应和L同周期,为Al元素,则
A.R为Be,与Al位于周期表对角线位置,性质相似,Al的氧化物的水化物为两性氢氧化物,则Be的氧化物对应的水化物可能具有两性,故A正确;
B.S在空气中燃烧只生成SO2,须在催化剂的条件下反应生成SO3,故B正确;
C.Al3+和O2-具有相同的核外电子排布,原子序数越大,半径越小,则离子半径大小:r(Al3+)<r(O2-),故C正确;
D.Mg2+核外有2个电子层,S2-核外有3个电子层,二者电子层结构不同,故D错误.
故选D.
本题解析:
本题难度:简单
3、简答题 元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑨九种元素在周期表中的位置.
族
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0
2
④
⑤
⑥
⑦
⑨
3
①
②
③
⑧
|
请回答:
(1)画出元素⑨的原子结构示意图______.
(2)九种元素中非金属性最强的是______(填元素符号).
(3)①、②两种元素原子半径比较:①______②(填“<”或“>”).在①、②、③三种元素的氧化物对应的水化物中,碱性最强的是______(填化学式).
(4)⑦、⑧两种元素组成的氢化物的热稳定性比较:⑦______⑧(填“<”或“>”).
(5)元素⑤对应的氢化物的化学式是______,其水溶液的pH______7(填“<”或“>”).④、⑤两种元素对应的最高价含氧酸的酸性强的是______(填化学式).
(6)①、⑥两元素形成的化合物的电子式为______,该化合物是由______(填“共价键”“离子键”)键形成的.
参考答案:根据元素在周期表中的分布情况,可以确定①是Na,②是Mg,③是Al,④是C,⑤是N,⑥是O,⑦是F,⑧是Cl,⑨是Ne.
(1)Ne原子的结构示意图为:
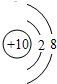
,故答案为:
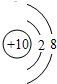
;
(2)同周期元素的原子从左到右非金属性逐渐增强,同一主族元素的原子从下到上非金属性逐渐增强,所以非金属性最强的元素在右上角,即为F,故答案为:F;
(3)根据元素周期律:同周期元素原子半径从左到右逐渐减小,所以原子半径Na>Mg,最高价氧化物对应水化物的碱性逐渐增强,所以碱性:NaOH>Mg(OH)2>Al(OH)3,
故答案为:>;?NaOH;
(4)根据元素周期律:同主族元素从上到下氢化物的稳定性逐渐减弱,所以稳定性HF>HCl,故答案为:>;
(5)元素N对应的氢化物的化学式是NH3,其水溶液氨水是弱碱,显碱性,它的pH>7,C、N两种元素对应的最高价含氧酸的酸性:硝酸>碳酸,故答案为:NH3;>;HNO3;
(6)Na、O两元素形成的化合物为氧化钠,氧化钠是氧离子和钠离子间通过离子键形成的离子化合物,它的电子式为

,
故答案为:

;离子.
本题解析:
本题难度:一般
4、选择题 元素周期表的过渡金属中能找到( )
A.新制农药元素
B.强氧化剂
C.制半导体元素
D.制耐高温合金元素
参考答案:A、新制农药元素可以从周期表的右上角中的非金属元素中找到,故A错误;
B、强氧化剂位于元素周期表的右上角,如氯气、氧气、氟气等,故B错误;
C、制半导体的材料在金属和非金属的分界线附近找,故C错误;
D、制耐高温合金元素在元素周期表的过渡金属中能找到,故D正确.
故选D.
本题解析:
本题难度:简单
5、填空题 Q、W、X、Y、Z为5种短周期元素,且原子序数依次增大.W、X与Y同周期,Y与Z同主族.Q与W可以按照原子个数比4∶1形成化合物甲,且甲分子中含有10个电子.Q与X形成化合物乙,乙可与Z的最高价氧化物的水化物按照物质的量之比?2∶1反应形成盐丙.
(1)甲的电子式是________________.
(2)Q和Y形成的既含极性键又含非极性键的共价化合物的化学式是____________.
(3)向少量丙溶液中加入浓Ba?(OH)2溶液至过量并加热,反应的离子方程式是________________________________________________________________________.
参考答案:(1) ?
?
(2)H2O2
(3)2NH4++SO42-+Ba2++2OH- BaSO4↓+2NH3↑+2H2O
BaSO4↓+2NH3↑+2H2O
本题解析:
本题难度:一般