微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述中,甲金属一定比乙金属活泼性强的是( )
A.甲原子电子层数比乙原子的电子层数多
B.在甲乙两种金属和盐酸构成的原电池中,甲作正极,乙作负极
C.1mol甲和乙分别与足量的盐酸反应,产生H2的量:甲>乙
D.常温时,甲能从水中置换出氢,而乙不能
参考答案:A、如金属不位于同一主族,则不能根据电子层数的多少来判断金属的活泼性强弱,故A错误;
B、在甲乙两种金属和盐酸构成的原电池中,甲作正极,乙作负极,说明乙活泼,故B错误;
C、产生氢气的多少取决于金属失去电子数的多少,与金属的活泼性无关,故C错误;
D、金属的活泼性越强,越易与水反应,故D正确.
故选D.
本题解析:
本题难度:简单
2、推断题 有A、B、C、D、E五种元素,原子序数依次增大,位于不同的三个短周期,其中B与D为同一主族元素,它们可形成化合物DB2、DB3,在同周期元素中,C的金属性最强,E的非金属性最强;请回答:
(1)写出A、E三种元素的名称:A____________,E_____________。
(2)A、B形成的原子个数比为1∶1的化合物的电子式为__________________,该化合物与DB2化合生成一种强酸的化学方程式为:__________________________。
(3)已知在一定条件下1mol DB2完全转化为气态DB3,放出98.3 kJ的热量。该反应的热化学方程式是
_____________________________,工业上进行这一反应的设备是_____________,反应的适宜条件为
________________________。
(4)用铂作电极电解由C、E形成化合物的饱和溶液时,检验阳极产物的实验方法为________________________________________;电解一段时间后,将阳极产物和阴极溶液混合,反应的离子方程式是
_____________________________。工业实际中常采用阳离子交换膜电解槽进行电解,若某一电极由碳钢网制成,则该电极为电解槽的___________(填“阴”或“阳”,下同)极,精制的由C、E形成的化合物的饱和溶液进入_________极室。
参考答案:(1)氢;氯
(2) ;H2O2+SO2=H2SO4
;H2O2+SO2=H2SO4
(3)2SO2(g)+O2(g)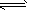 2SO3(g),ΔH=-196.6 kJ/mol;接触室;常压、400~500℃、催化剂;用湿润的
2SO3(g),ΔH=-196.6 kJ/mol;接触室;常压、400~500℃、催化剂;用湿润的
KI淀粉试纸接近阳极产物,试纸变蓝;Cl2+2OH-==Cl-+ClO-+H2O;阴;阳
本题解析:
本题难度:一般
3、推断题 A~D为短周期元素,其性质或结构信息如下表所示

请根据表中信息回答下列问题:
(1)A元素在元素周期表中的位置是___________,能说明A单质与D单质氧化性相对强弱的离子方程式为
______________。
(2)B的单质与大多数同类的物质相比较在化学性质上有一些不同之处,请说明其中一点(用文字或化学方程式表述)______________。
(3)A与C形成化合物的电子式为______________。
(4)D的最高价氧化物对应的水化物的浓溶液的特性有____、 ____、____
(5)B和D形成的化合物只能用干法制取,写出该方法的化学方程式:______________。
参考答案:(1)第三周期ⅦA族;Cl2+S2-=2Cl-+S↓(其他合理答案也可以)
(2)2Al+2NaOH+2H2O=2NaAlO2+3H2↑(或铝热反应、铝在冷的浓硫酸或浓硝酸中钝化等)(3) (4)吸水性;脱水性;强氧化性;
(4)吸水性;脱水性;强氧化性;
(5)2Al+3S Al2S3
Al2S3
本题解析:
本题难度:一般
4、选择题 下列关于短周期元素说法正确的是( )
①均为主族元素,除稀有气体外,最高化合价与其族序数相等
②元素所形成的单质可能是金属晶体、分子晶体、离子晶体或原子晶体
③元素的氢化物水溶液可能显酸性,也可显碱性
④元素气态氢化物的沸点随相对分子质量增大而增大.
A.①②③④均不正确
B.只有①②③正确
C.只有③④正确
D.只有③正确
参考答案:①主族元素O、F没有正价,所以不满足最高化合价与其族序数相等,故①错误;
②元素所形成的单质可能是金属晶体(如金属单质)、分子晶体(如氢气、氧气等)或原子晶体(金刚石、硅等),单质不能形成离子晶体,故②错误;
③元素的氢化物水溶液可能显酸性(如HCl等),也可显碱性(如氨气等),故③正确;
④元素气态氢化物的沸点一般随相对分子质量增大而增大,但含有氢键的物质的沸点较高,如水的沸点高于硫化氢,故④错误;
故选D.
本题解析:
本题难度:简单
5、选择题 下列有关物质性质的比较顺序中,不正确的是( )
A.微粒半径:K+>Na+>Mg2+
B.热稳定性:HF>HCl>HBr
C.还原性:Li>Na>K
D.酸性:HClO4>H2SO4>H3PO4
参考答案:A、电子层结构相同核电荷数越大离子半径越小,故离子半径Na+>Mg2+,最外层电子数相同电子层越多离子半径越大,所以微粒半径K+>Na+,故微粒半径K+>Na+>Mg2+,故A正确;
B、同主族自上而下元素的非金属性减弱,故非金属性F>Cl>Br,所以氢化物稳定性HF>HCl>HBr,故B正确;
C、同主族自上而下元素的金属性增强,金属单质的还原性增强,故还原性Li<Na<K,故C错误;
D、同周期自左而右元素的非金属性增强,故非金属性P<S<Cl,所以酸性HClO4>H2SO4>H3PO4,故D正确.
故选C.
本题解析:
本题难度:简单