微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 除去下列物质的少量杂质(括号内为杂质),所选试剂和分离方法能达到实验目的是
A.A
B.B
C.C
D.D
参考答案:BD
本题解析:分析:根据除杂质至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质,以此来解答.
解答:A.乙酸能与NaOH溶液反应,但乙酸乙酯也能与NaOH反应,故A错误;
B.乙酸具有酸性,能和氧化钙反应生成盐和水,用蒸发的方法分离,乙醇易挥发,而乙酸钙难以挥发,可将二者分离,故B正确;
C.除杂所加的试剂是过量的,溴单质易溶于苯,过量的溴无法用过滤分离,引入了新杂质,故C错误;
D.淀粉是胶体,氯化钠是溶液,胶粒不能透过半透膜,溶液可以透过半透膜,故可用渗析分离,故D正确.
故选BD.
点评:本题主要主要考查了物质的除杂,抓住除杂质至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质是解题的关键.
本题难度:简单
2、填空题 (10分)已知A、B、C为同一短周期的三种元素,它们的原子序数依次增大且和为40;A是该周期中(除稀有气体元素外)原子半径最大的元 素,B元素的原子核外M层上的电子数比K层上的电子数多1。解答26-30小题:
素,B元素的原子核外M层上的电子数比K层上的电子数多1。解答26-30小题:
1.A原子的结构示意图为__________;A元素在周期表中位置为_____________________。
2.写出B的最高价氧化物与A的最高价氧化物对应水化物的溶液之间反应的离子方程式_______________________________________。
3.A和C形成的化合物的电子式为_____________,该化合物的水溶液呈__________性(填“酸”或“碱”)。
参考答案:1. 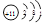 ;第三周期IA族? 2.Al2O3+2OH-→2AlO2-+H2O
;第三周期IA族? 2.Al2O3+2OH-→2AlO2-+H2O
3.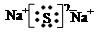 ;碱
;碱
本题解析:略
本题难度:一般
3、填空题 ( 9分)A、B都是短周期元素,原子最外层电子排布式分别为(n+1)sx、nsx+1npx+3。A与B可形成化合物D。D溶于水时有气体逸出,该气体能使带火星的木条复燃。请回答下列问题:
(1)比较电离能:I1(A)________I1(B)(填“>”或“<”,下同),比较电负性:A________B。
(2)通常A元素的化合价是________,对A元素呈现这种价态进行解释:
①用原子结构的观点进行解释: _______________________________________。
②用电离能的观点进行解释: ___________________________________________。
③写出D跟水反应的离子方程式:_______________________________________。
参考答案:( 9分 ) (1)①< (1分)?②< (1分)? (2)+1价(1分)
①钠原子失去一个电子后形成1s22s22p6式的原子轨道全充满的+1价阳离子。该离子结构体系能量低,极难再失去电子(2分)
②Na原子的第一电离能相对较小,第二电离能比第一电离能大很多倍。通常Na原子只能失去一个电子?(2分)③2Na2O2+2H2O===4Na++4OH-+O2↑(2分)
本题解析:根据构造原理可知,s轨道最多容纳2个电子,所以x=1。D溶于水时有气体逸出,该气体能使带火星的木条复燃,所以D是过氧化钠,则n=2,所以A是钠,B是氧元素。
(1)非金属性越强,第一电离能越大,所以钠的第一电离能小于氧元素的。同样电负性也是钠的小于氧元素的。
(2)钠最外层电子数是1个,通常显+1价。
①由于钠原子失去1个电子后形成1s22s22p6式的原子轨道全充满的+1价阳离子。该离子结构体系能量低,极难再失去电子,所以通常显+1价。
②由于Na原子的第一电离能相对较小,而第二电离能比第一电离能大很多倍。通常Na原子只能失去一个电子,因此显+1价。
③过氧化钠溶于水生成氧气和氢氧化钠,反应的离子方程式是2Na2O2+2H2O===4Na++4OH-+O2↑。
点评:在判断原子核外电子的排布时,应该利用构造原理进行分析。另外本题的关键还在于能使带火星的木条复燃的气体是氧气,继而逐一分析即可。
本题难度:一般
4、选择题 元素周期律产生的根本原因就是随着元素原子序数的递增
A.元素的相对原子质量逐渐增大
B.核外电子排布呈周期性变化
C.原子半径呈周期性变化
D.元素主要化合价呈周期性变化
参考答案:B
本题解析:结构决定性质,核外电子排布呈周期性变化,决定了元素性质呈周期性变化。
本题难度:简单
5、选择题 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,下列推断正 确的是
?
A.T的氧化物是光导纤维的主要成分
B.W的氢化物的化学式为HCl
C.R的最高正价氧化物的水化物是弱电解质
D.Q与氢形成的化合物均含极性共价键
参考答案:D
本题解析:图中位于第三周期第IIIA族元素T为铝,以此为突破口,可以顺利推导出Q、R、W分别为碳、氮、硫。T是铝,铝的氧化物为氧化铝,光导纤维的主要成分是二氧化硅,故A项错误;W是硫,硫的氢化物为硫化氢(H2S),故B项错误;R是氮,氮元素最高正价氧化物的水化物是硝酸(HNO3),硝酸是强酸、强电解质,故C项错误;Q是碳,碳与氢形成的化合物成为烃,烃分子中一定含有C—H键,碳、氢是不同非金属,则C—H键是极性共价键,故D项错误。
本题难度:简单