微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)X、Y、Z、E、F为五种短周期元素,原子序数依次递增。X+中只含有一个质子;Y的正、负化合价绝对值相等,在同族元素中氢化物最稳定;Z的原子核内质子数是Y的最外层电子
数的2倍;F与Z同主族;E与X同主族。试推断:
⑴下列元素分别是:Y ??Z??F??。(用元素符号表示)
⑵X、Z、E形成化合物的电子式为??,所含有的化学键有?
??;它属于??化合物(填离子或共价)
参考答案:(1)C? O? S? (2) 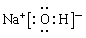 、离子键和极性键、离子
、离子键和极性键、离子
本题解析:(1)X+中只含有一个质子,所以X是氢元素。Y的正、负化合价绝对值相等,则Y是第ⅣA元素。又因为Y在同族元素中氢化物最稳定,所以Y是碳元素。则Z是氧元素,F是硫元素,E是钠。
(2)X、Z、E形成化合物是氢氧化钠,含有离子键和极性键,属于离子化合物,其电子式为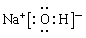 。
。
本题难度:简单
2、选择题 某一周期ⅡA族元素的原子序数为x,则同周期的ⅢA族元素的原子序数不可能为(?)
A.x+8
B.x+1
C.x+11
D.x+25
参考答案:A
本题解析:略
本题难度:简单
3、填空题 (7分)X、Y、Z、W、L、M六种短周期主族元素的原子序数依次增大,其中X、M的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,Z在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。
用化学用语回答下列问题:
(1)L的元素符号为___________;M在元素周期表中的位置为__________________。
(2)Y、L、M的最高价含氧酸的酸性由弱到强的顺序是_________________________。
(3)Y的最高价氧化物的电子式为__________。原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是_________________。
(4)R与Y同周期,R的单质分子R2中有3个共价键,R与L能形成一种新型无机非金属材料,其化学式是___________________。
参考答案:
MnO2
本题解析:W是地壳中含量最多的金属元素,则W是Al。L的单质晶体熔点高、硬度大,是一种重要的半导体材料,且原子序数大于铝的,所以L是Si。X、M的单质是气体,原子序数大于Si的,所以M是Cl。Y的原子最外层电子数是其电子层数的2倍,原子序数小于铝的,所以Y是C。X的原子序数小于C的,所以X是氢。Z在同周期的主族元素中原子半径最大,则Z是Na。
(2)非金属性越强,最高价含氧酸的酸性就越强,所以顺序为H2SiO3 < H2CO3 < HClO4。
(3)原子序数比C多2的是氧。和氢形成的化合物双氧水分解生成氧气和水。
(4)R与Y同周期,R的单质分子R2中有3个共价键,则R是N。根据N和Si的价电子可知,化合物的化学式为Si3N4。
本题难度:一般
4、选择题 下列叙述中错误的是 (?)
A.原子半径:Cl>S>O
B.还原性:Na>Mg>Al
C.稳定性:HF>HCl>HBr
D.酸性:HClO4>H2SO4>H3PO4
参考答案:A
本题解析:同主族元素,从上至下,原子半径逐渐增大,同周期元素,从左至右原子半径逐渐减小,所以原子半径: S > Cl>O,故A错误。
本题难度:简单
5、选择题 下列各组顺序的排列不正确的是
A.原子半径:Na<Mg<Cl
B.热稳定性:HCl>H2S>PH3
C.酸性强弱:H2SiO3<H2CO3<H2SO4
D.碱性强弱:LiOH <NaOH < KOH
参考答案:A
本题解析:考查元素周期律的应用。同周期自左向右原子半径逐渐减小,非金属性逐渐增强,相应氢化物的稳定性也是逐渐增强的,A不正确,B增强。非金属性越强,最高价氧化物的水化物的酸性越强,金属性越强,最高价氧化物的水化物的碱性越强,CD都是正确的,答案选A。
本题难度:简单