微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (每空2分,共12分)推断下列化合物的化学式:
⑴X、Y两元素能形成XY2型化合物,XY2中共有38个电子,若XY2是离子化合物,其化学式是?;若XY2是共价化合物其化学式是?。
⑵第三周期内,X、Y两元素的原子序数之差为4,它们组成的XY型化合物,其化学式为??。
⑶1mol某物质含有不同周期三种元素的原子各1mol,其质子总数为20mol,该物质的化学式为??。
⑷某非金属X的最高正价为+m,它的最高价氧化物对应的水化物中有b个氧原子,则这种酸的化学式是?。
⑸X元素的最高正价和负价绝对值之差为6,Y元素和X元素原子的次外电子层上都有8个电子,X和Y形成的化合物在水溶液中能电离出电子层结构相同的离子,则该化合物是?。
参考答案:.⑴CaF2?CS2 ?(2)MgS?(3)NaOH 或 LiHS?
(4)H2b-mXOb?(5)KCl?或CaCl2
本题解析:(1)如果是离子化合物,则根据化学式可知X的化合价是+2价。Y是-1价。XY2中共有38个电子,因此是CaF2 。XY2是共价化合物,则其化合价分别是+4价和-2价,即是CS2。
(2)组成的XY型化合物的应该是第IA和第ⅦA、第ⅡA和第ⅥA以及第ⅢA和第ⅤA。又因为第三周期内,X、Y两元素的原子序数之差为4,所以是MgS。
(3)含有不同周期三种元素,因此一定含有氢元素,所以根据质子数可判断,可以是NaOH 或 LiHS。
(4)b个氧原子的负价共计是2b,所以含有的氢原子数是2b-m,即化学式为H2b-mXOb。
(5)X元素的最高正价和负价绝对值之差为6,则X是第ⅦA元素。X元素原子的次外电子层上有8个电子,所以X是氯元素,所以化学式为KCl 或CaCl2。
本题难度:一般
2、选择题 下列原子中电离能最大的是( )
A.Be
B.C
C.Al
D.Si
参考答案:
B
本题解析:
判断元素原子的电离能大小,根据该元素所在周期表中的位置。同一周期从左到右,第一电离能逐渐增大;同一主族从上到下,电离能逐渐减小。
本题难度:一般
3、选择题 下列仪器:①容量瓶?②蒸镏烧瓶?③漏斗?④燃烧匙?⑤天平?⑥分液漏斗?⑦胶头滴管,常用于物质分离的是
A.①③⑤
B.②④⑦
C.①②⑥
D.②③⑥
参考答案:D
本题解析:试题分析:常用于物质分离的方法有过滤、萃取、分液、蒸馏等。其中过滤的仪器是漏斗、萃取和分液用分液漏斗,蒸馏用蒸馏烧瓶,所以答案选D。
考点:考查常见仪器的使用
点评:化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,通过该题的考查,使学生重点掌握实验基本操作的规范性和准确及灵活运用的能力。
本题难度:一般
4、选择题 下列各组元素按第一电离能增加顺序排列的是(?)
A. Li、Na、K?B.B、Be、Li?C.O、F、Ne? D. C、P、Se
参考答案:C
本题解析:A. Li、Na、K?,第一电离能逐渐减小;
B.B、Be、Li,Be的2s全满,故第一电离能大于Li;
C.O、F、Ne 逐渐增大;
D. C、P、Se,P的3p处于半满,第一电离能大于Se。
本题难度:一般
5、填空题 I.X、W、Y、Z均为短周期主族元素,原子序数依次增大,X原子的最外层电子数是W的4倍,X、Y在周期表中相对位置如下图。
?
(1)X在周期表中的位置是________。
(2)Z单质与石灰乳反应的化学方程式为________。
(3)Y的气态氢化物通入FeCl3溶液中,有Y单质析出,该反应的离子方程式为___。
(4)W-Y高能电池是一种新型电池,它以熔融的W、Y单质为两极,两极之间通过固体电解质传递W+离子。电池反应为:16W(l)+nY8(l) 8W2Yn(l)。放电时,W+离子向___极移动;正极的电极反应式为________。
8W2Yn(l)。放电时,W+离子向___极移动;正极的电极反应式为________。
II.在容积可变的密闭容器中充入A、B、C三种气体,发生反应:x A+yB zC,恒温下,通过压缩容器体积改变压强,分别测得A的平衡浓度如下表:
zC,恒温下,通过压缩容器体积改变压强,分别测得A的平衡浓度如下表:
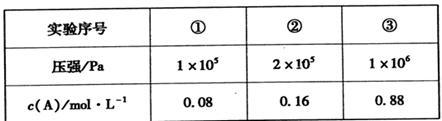
(5)根据①②数据分析得出:x+y ___z(填“>”、“<”或“=”)。
(6)该温度下,当压强为1×106 Pa时,此反应的平衡常数表达式为________。
参考答案:I.(1)第二周期第ⅣA族;(2)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(3)H2S+2Fe3+=2Fe2++2H++S↓;(4)nS8+16e-=8Sn2-;
II.(5)=;(6)K=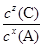 。
。
本题解析:I.X、W、Y、Z均为短周期主族元素,原子序数依次增大,X原子的最外层电子数是W的4倍,则根据X、Y在周期表中相对位置可知,X一定是第二周期元素,W、Y、Z均是第三周期元素,其中X是第ⅣA族的碳元素,W是钠元素,Y是硫元素,Z是氯元素。
(1)X在周期表中的位置是第二周期第ⅣA族;
(2)氯气与石灰乳反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(3)H2S具有还原性,能把铁离子氧化生成单质硫,所以Y的气态氢化物通入FeCl3溶液中,有Y单质析出的离子方程式为H2S+2Fe3+=2Fe2++2H++S↓;
(4)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。因此放电时,Na+离子向正极移动;正极硫得到电子,电极反应式为nS8+16e-=8Sn2-;
II.(5)根据①②数据分析得出,压强变为原来的2倍时,A的浓度变为原来的2倍,这说明增大压强平衡不移动,因此正方应是体积不变的可逆反应,即x+y=z;
(6)由②③数据可知,压强变为原来的5倍时A的浓度大于原来的5倍,这说明增大压强平衡向逆反应方向移动,即正方应是体积增大的可逆反应。所以此时B不再是气态,因此该温度下反应的平衡常数表达式为K=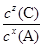 。
。
本题难度:困难