微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 下表为元素周期表的一部分,针对表中①~⑥元素,回答下列问题
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ①
| ?
| ②
| ?
| ?
|
③
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ④
| ?
| ?
| ⑤
| ⑥
| ?
|
(1)②元素在周期表中的位置是第二周期?族
(2)写出①的最高价氧化物的电子式?
(3)⑤和⑥两种元素的最高价氧化物对应水化物中酸性较强的是?(填化学式)
(4)写出④的单质和③的最高价氧化物的水化物反应?
参考答案:(1)ⅥA (2)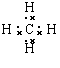 (3)HClO4?(4)2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(3)HClO4?(4)2Al+2NaOH+2H2O=2NaAlO2+3H2↑
本题解析:根据元素在周期表中的相对位置可知①~⑥元素分别是C、O、Na、Al、S、Cl。
(1)②元素在周期表中的位置是第二周期第ⅥA族。
(2)写出①的最高价氧化物是甲烷,含有共价键,其的电子式是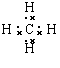 。
。
(3)非金属性越强,最高价氧化物的水化物的酸性越强,则⑤和⑥两种元素的最高价氧化物对应水化物中酸性较强的是HClO4。
(4)金属铝能和氢氧化钠溶液反应生成偏铝酸钠和氢气,则④的单质和③的最高价氧化物的水化物反应的化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑。
点评:该题是高考中的常见题型,属于基础性的试题。试题基础性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力,考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般
2、选择题 最近,我国某物理研究所取得重大科技成果,研制出由18O所形成的单质气体。18O是一种稳定的同位素,称为重氧。下列有关说法不正确的是( )
A.1.8 g18O形成的气体的物质的量是0.05 mol
B.0.1 mol重氧水H218O所含的中子数约为6.02×l023个
C.0.2 mol18O2气体的体积约为4.48 L
D.18O2气体的摩尔质量为36 g/mol
参考答案:C
本题解析:A中1.8 g18O所形成的气体为18O2,所以其物质的量为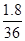 =0.05 mol。
=0.05 mol。
B中H218O中所含的中子数为18-8=10,所以,0.1 mol H218O的中子数为0.1×10 NA=NA;
C中0.2 mol18O2气体在标准状况下才能为4.48 L。
D中18O2的摩尔质量为18×2=36 g/mol。
本题难度:一般
3、选择题 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是
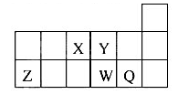
A 元素X与元素Z的最高正化合价之和的数值等于8
B 原子半径的大小顺序为:rX>rY>rZ>rW>rQ
C 离子Y2-和Z 3+的核外电子数和电子层数都不相同
D 元素W的最高价氧化物对应的水化物的酸性比Q的强
参考答案:A
本题解析:根据周期表的结构可推出元素分别为:
X —N ;Y —O ;Z—Al ;W—S ;Q—Cl
A 元素最高正化合价一般等于其主族数。
B 同周期原子半径从左到右依次减小,同主族从上到下依次增大。
C 离子Y2-和Z 3+都为10微粒,核外电子数和电子层数都相同。
D元素最高价氧化物对应的水化物的酸性是与非金属性一致的,因此酸性Q的强。答案选A。
本题难度:一般
4、填空题 (15分)A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,相关信息如下表:
元素
| A
| B
| C
| D
| E
|
相关
信息
| 最高正价与最低负价代数和为2
| 与元素C可形成离子个数比为2:1和1:1的化合物
| 单质质软,通常保存在煤油中
| D元素可形成两种氧化物,其中一种是形成酸雨的主要成分
| 其单质是用途最广泛的金属,人体缺少该元素易患贫血症
|
回答以下问题(化学用语中的元素用相应的元素符号表示)。
(1)C在元素周期表中的位置是?。
(2)B、D元素对应的相对分子质量最小的氢化物受热分解所需温度B?D(填“>”、“<”或“=”)。
(3)检验E3+离子的方法是?。
(4)鉴别D的两种氧化物的试剂是?(仅限一种);常温常压下DO2与一氧化碳反应生成 1.6g D单质与另一种氧化物,并放出14.86kJ的热量,写出此反应的热化学方程式?。
(5)0.1mol·L-1C2D溶液中各种离子浓度从大到小的顺序是?。
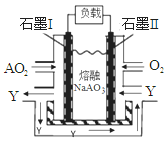
(6)AO2、O2和熔融NaAO3可制作燃料电池,其原理如图所示。该电池在使用过程电极Ⅰ生成氧化物Y,写出电极Ⅱ的反应式?。
参考答案:(1)第三正确第IA族 (2)>
(3)取少量的样品于试管中,滴加KSCN溶液,若溶液变红色,则含有铁离子
(4)品红溶液(或氯化钡溶液) SO2(g)+2CO(g)=S(s)+2CO2(g) △H=-297.2kJ/mol
(5)c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)?(6)O2+2N2O5+4e-=4NO3-
本题解析:A最高正价与最低负价代数和为2,则A是第ⅤA族元素,且A的原子序数最小,所以A是氮元素。C单质质软,通常保存在煤油中,则C是钠元素。B与元素C可形成离子个数比为1:2和1:1的化合物,则在短周期中符合条件的是氧化钠和过氧化钠,则B是氧元素。D元素可形成两种氧化物,其中一种是形成酸雨的主要成分,因此D是硫元素。E单质是用途最广泛的金属,人体缺少该元素易患贫血症,且E不是短周期元素,所以E是铁。
(1)钠的原子序数是11,在元素周期表中的位置是第三正确第IA族。
(2)非金属性越强,氢化物的稳定性越强,氧元素的非金属性强于硫元素,则B、D元素对应的相对分子质量最小的氢化物受热分解所需温度B>D。
(3)检验铁离子的方法是取少量的样品于试管中,滴加KSCN溶液,若溶液变红色,则含有铁离子。
(4)二氧化硫能使品红溶液褪色,因此鉴别D的两种氧化物的试剂是品红溶液;常温常压下DO2与一氧化碳反应生成 1.6g D单质与另一种氧化物,并放出14.86kJ的热量,则生成32g硫放出的热量是14.86kJ×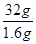 =297.2kJ,因此此反应的热化学方程式为SO2(g)+2CO(g)=S(s)+2CO2(g) △H=-297.2kJ/mol。
=297.2kJ,因此此反应的热化学方程式为SO2(g)+2CO(g)=S(s)+2CO2(g) △H=-297.2kJ/mol。
(5)硫化钠溶于水,硫离子水解溶液显碱性,则0.1mol·L-1C2D溶液中各种离子浓度从大到小的顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)。
(6)根据装置图可知,氧气通入的电极应该是正极,得到电子,则电极I是负极,二氧化氮失去电子,其氧化产物Y应该是N2O5,所以根据电解质是熔融NaNO3可知电极Ⅱ的反应式是O2+2N2O5+4e-=4NO3-。
本题难度:一般
5、选择题 有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质是一种重要的半导体材料。下列说法中,正确的是(?)
A.X、Y、Z、W的原子半径和原子序数都依次增大
B.W、Z、M元素的气态氢化物热稳定性依次增强
C.M分别和Y、Z所形成化合物都可以和碱反应
D.X分别和M、W所形成的化合物含化学键类型一定相同
参考答案:C
本题解析:由X、Y、Z、W、M为五种短周期元素,及X+与M2-具有相同的电子层结构,可以推出X为你金属钠元素,M为氧元素,又因Z、M同主族,故Z为硫元素;Y的单质是一种重要的半导体材料,Y为硅元素;因X、Y、Z、W同周期,且离子半径:Z2->W-故W为氯元素。
本题难度:一般