微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质.已知:甲+乙=丁+己,甲+丙=戊+己;?0.1mol?L-1丁溶液的pH为13(25℃).下列说法正确的是( )
A.原子半径:W>Z>Y>X
B.Y元素在周期表中的位置为第三周期第ⅣA族
C.1mol甲与足量的乙完全反应共转移了1mol电子
D.1.0L0.1mol?L-1戊溶液中阴离子总的物质的量小于0.1mol
参考答案:C
本题解析:
本题难度:一般
2、简答题 已知A、B均是由两种短周期元素组成的化合物,A中某元素的质量分数为75%,C、J是同周期元素的气态氢化物,X为无色液体,D具有两性.反应生成的水均已略去.它们有如下图所示的关系.
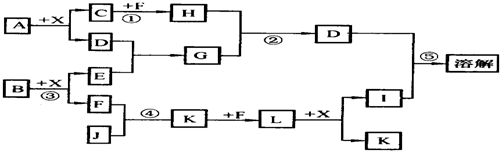
(1)写出化学式:A.______,B.______,C.______.
(2)反应③中每生成lmolF,转移电子的数目为:______.
(3)反应④的化学方程式为:______.
(4)写出离子方程式分别为:反应②______;
反应⑤______.
(5)反应①中,每1.00g?C与足量的F作用,恢复到25℃放出55.6kJ热量,写出反应①的热化学方程式.______.
参考答案:1.X为无色液体,推断X为H2O;
2.D具有两性,可知D为Al2O3或Al(OH)3,而Al2O3要经过氢氧化铝脱水或铝直接与氧气化合而得,图中显然不具备这样的条件,因此D为Al(OH)3,D由A反应而来,A中含铝元素;
3.因为D遇I溶解,可知I为强酸或强碱,但I由J一路反应而来,又有J为第二周期元素的气态氢化物,因此J为非金属氢化物,I为强酸,而L+X生成I+K,只有硝酸的生成(3NO2+H2O=2HNO3+NO)符合这一模式,L为NO2,K为NO,由NO+F到NO2,F为O2.顺便也可知J中含氮元素,J为NH3;
4.因为C也为第二周期元素的气态氢化物,而第二周期元素的气态氢化物一般只研究碳与氮元素的氢化物(若C为HF,则A为AlF3,不合题意;而硼的性质一般不做研究,否则要给提示或条件),J为NH3,所以C为烃类,A为碳与铝的化合物,结合给出的质量分数,A为Al4C3,它与水发生水解反应时,碳元素的价态不变,因此产物C为甲烷(CH4),它与F(氧气)反应除水之外的产物H为CO2.A+X=C+D反应方程式:Al4C3+12H2O→4Al(OH)3+3CH4↑;
5.因为H与G反应生成D(Al(OH)3),G由D反应来,因此G为偏铝酸盐,E为强碱,因为E由短周期元素化合物B与水反应来,所以E为NaOH,G为NaAlO2,因为B+水生成NaOH+O2,所以B为Na2O2.综上所述判断出的各物质为:A为Al4C3 ;B为Na2O2;C为CH4;D为Al(OH)3;E为NaOH;F为O2;G为NaAlO2;H为CO2;I为HNO3;为NH3;K为NO;LNO2;X为H2O;
(1)依据分析推断得到A、B、C分别为:Al4C3、Na2O2、CH4,故答案为:Al4C3;Na2O2;CH4;
(2)反应③为2Na2O2+2H2O=4NaOH+O2;反应中过氧化钠自身氧化还原反应,氧元素化合价从-1价变化为0价,-2价,反应中每生成lmolF(O2)转移电子物质的量为2mol,转移电子数为1.204×1024,故答案为:1.204×1024;
(3)反应④是氨气的催化氧化反应,反应的化学方程式为:4NH3+5O2催化剂.△4NO+6H2O,故答案为:4NH3+5O2催化剂.△4NO+6H2O;
(4)反应②是二氧化碳气体通入偏铝酸钠溶液中发生的反应,反应的离子方程式为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-或AlO2-+CO2+2H2O=2Al(OH)3↓+HCO3-;反应⑤是氢氧化铝在硝酸中溶解的反应,反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,
故答案为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-或AlO2-+CO2+2H2O=2Al(OH)3↓+HCO3-;Al(OH)3+3H+=Al3++3H2O;
(5)反应①是甲烷燃烧生成二氧化碳和水的反应,每1.00g?CH4与足量的F(O2)作用,恢复到25℃水为液体,放出55.6kJ热量;依据化学方程式计算1mol甲烷燃烧放热为889.6KJ;
反应的热化学方程式为:CH4(g)+2O2(g)?点燃?.?CO2(g)+2H2O(l)△H=-889.6kJ?mol-1,
故答案为:CH4(g)+2O2(g)?点燃?.?CO2(g)+2H2O(l)△H=-889.6kJ?mol-1.
本题解析:
本题难度:一般
3、简答题 A、B、C为单质,其中一种是金属,通常状况下,A为固体.B为液体(且主要从海水中提取),C为气体,其余均为化合物,X是一种具有挥发性的无氧强酸,E为黑色固体,H为无色液体,它们之间的转化关系如图(其中某些反应条件和产物已略去)
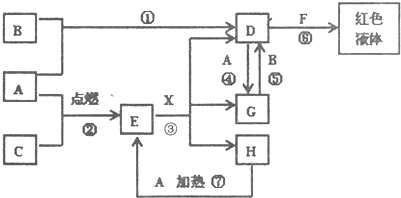
(1)写出:A的化学式______,F的化学式______,H的电子式______.
(2)在反应①-⑦中,不属于氧化还原反应的是______?(填序号).
(3)完成E和X反应的离子方程式:______.
(4)与B同族的元素中最高价氧化物的水化物其酸性最强的是______?(填化学式)
(5)完成H和某种化合物快速制C的化学方程式______,每生成0.15 mol C电子转移______mol.
(6)B蒸气与过量氨气混合有白烟及另一种气体单质产生,该反应的化学方程式为:______.
参考答案:依据转化关系的特征和物质性质分析判断,单质A和H反应生成E为黑色晶体,E黑色固体和X酸反应生成D、G、H,其中DG之间可以实现相互转化,说明A为变价金属Fe,和C在点燃条件下生成黑色固体E为Fe3O4,C为O2,依据D+A=G说明D为含三价铁离子的化合物,F为含硫氰酸根离子的化合物,G为含Fe2+离子的化合物,H为H2O;依据G+B=D分析判断B是强氧化剂,常温下为液体的氧化剂单质判断为:Br2,所以推断D为FeBr3,得到G为FeBr2;X为HBr;
(1)通过以上分析知,A是Fe,F是KSCN,H是H2O,其电子式为:

,故答案为:Fe,KSCN,

;
(2)③⑥的反应中各元素的化合价不变,所以不属于氧化还原反应,故选③⑥;
(3)E是四氧化三铁,X是氢溴酸,四氧化三铁和氢溴酸反应生成溴化铁、溴化亚铁和水,离子反应方程式为:Fe3O4+8H+=Fe2++2Fe3++4H2O,
故答案为:Fe3O4+8H+=Fe2++2Fe3++4H2O;
(4)非金属的非金属性越强,其最高价含氧酸的酸性越强,与B同族的元素中F元素最高价含氧酸,所以最高价氧化物的水化物其酸性最强的是HClO4,故答案为:HClO4;
(5)水和过氧化钠反应生成氧气,反应方程式为:2Na2O2+2H2O=4NaOH+O2↑,每生成0.15 mol氧气转移电子的物质的量=2mol1mol×0.15mol=0.3mol,
故答案为:2Na2O2+2H2O=4NaOH+O2↑,0.3;
(6)溴和氨气反应生成溴化铵和氮气,反应方程式为:3Br2+8NH3=6NH4Br+N2,故答案为:3Br2+8NH3=6NH4Br+N2.
本题解析:
本题难度:一般
4、推断题 已知A为蓝色溶液,B、C、E、F为单质,其余均为化合物,其中B、L、F常温下为气体,且F为有色气体,C、E为金属,K的水溶液为黄色。各物质转化关系如图。
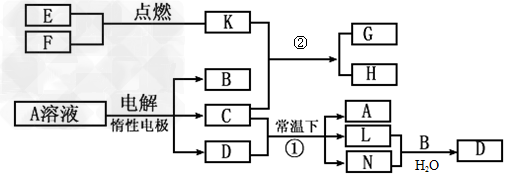
回答下列问题:
(1)反应②的化学方程式:____________?;
(2)反应①的离子方程式:_________________;
(3)用惰性电极电解400.00mL?A溶液,一段时间内测得溶液pH=1,则需要向溶液中加入__________,其质量为______g,才能使溶液恢复到电解前的状态(不考虑溶液体积变化)。?
(4)pH均为4的A溶液和D溶液中,由水电离出的c(H+)之比是_________。
(5)K和A的阳离子对H2O2分解的催化作用,为比较K和A对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
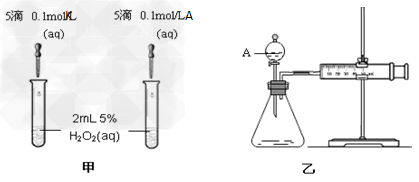
定性分析:如图甲可通过观察气泡产生的快慢可经定性比较得出结论。有同学提出该实验不太合理,其理由是__________________,
定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为__________,实验中需要测量的数据是___________。
参考答案:(1)2FeCl3?+?Cu?=2FeCl2?+?CuCl2
(2)3Cu?+?8H+?+2NO3-?=?3Cu2+?+?2NO↑?+?4H2O
(3)CuO;1.6
(4)106∶1
(5)两溶液的阴离子不同,也可能对H2O2的分解产生不同的作用;分液漏斗;收集40mL气体的时间
本题解析:
本题难度:一般
5、填空题 (13分)物质A、B、C、D为中学常见单质,其组成元素的原子序数依次减小,且其中只有三种是短周期元素,B为黄绿色气体。试根据下图中物质的相互转化关系回答下列问题。
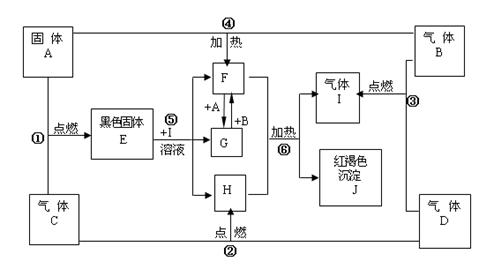
(1)A是_________
(2)在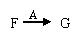 的转化中,A的作用是?;在①~⑥的反应中,不属于氧化
的转化中,A的作用是?;在①~⑥的反应中,不属于氧化 还原反应的是?。(多填或少填无分)
还原反应的是?。(多填或少填无分)
(3)写出A在高温下与H反应的化学反应方程式并标出电子转移的方向和数目
? ?。
(4)写出反应⑥的化学反应方程式 ?。
(5)已知在101 kPa 条件下,2 mol D完全燃烧生成液态生成物放出571.6 kJ热量;请书写表示D燃烧热的热化学方程式: ?
参考答案:(13分)
(1)铁(2分)
(2)还原剂(2分)⑤⑥(2分)(多填或少填无分)
(3)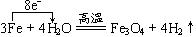 (2分)
(2分)
(4)FeCl3+3H2O Fe(OH)3↓+3HCl↑ (2分)
Fe(OH)3↓+3HCl↑ (2分)
(5)H2(g)+1/2 O2(g) = H2O(l);?⊿H =" —285.8" kJ/ mol?(3分)
本题解析:略
本题难度:一般