微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组物质依次表示a、b、c、d,满足如图所示转化关系的是(图中箭头表示一步转化)(?)

A.Si SiO2 H2SiO3 Na2SiO3
B.NH3 NO NO2 HNO3
C.Cu CuO Cu(OH)2 CuSO4
D.Na Na2O2 NaOH Na2CO3
参考答案:B
本题解析:略
本题难度:一般
2、简答题 如图的各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,B为液体,C能使湿润的红色石蕊试纸变蓝,A、B、C的物质的量之比为1:1:1.
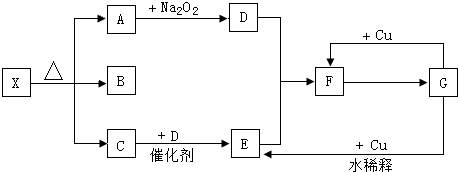
(1)写出下列各物质的化学式:X:______;B:______;F:______.
(2)写出A→D变化的反应方程式:______,若有1molNa2O2完全反应,则转移的电子数为______mol.
(3)写出G→E变化的化学方程式,并用双线桥标出电子转移的方向和数目:______.
(4)将等物质的量的E、F混合气通入NaOH溶液中,恰好被吸收,生成一种钠盐,试写出该反应的化学方程式:______.
(5)实验室里,检验X中阳离子的方法是______.
(6)120℃时,X物质完全分解的产物的平均相对分子量是______.(保留一位小数)
参考答案:C能使湿润的红色石蕊试纸变蓝,应为NH3,A和过氧化钠反应生成D为气体,且A是无色气体,所以A应为CO2,D为O2,氨气和氧气在催化剂条件下加热生成NO和水,E能和氧气反应,所以E是NO,F为NO2,F和B反应生成G,G和铜反应生成二氧化氮,G为HNO3,B为液体,应为H2O,A、B、C的物质的量之比为1:1:1,则X为NH4HCO3,
(1)由以上分析可知,X为NH4HCO3,B为H2O,F为NO2,
故答案为:NH4HCO3;H2O;NO2;
(2)A→D为Na2O2和CO2的反应,方程式为2CO2+2Na2O2═2Na2CO3+O2,反应中过氧化钠其氧化剂、还原剂作用,各占一半,故有1molNa2O2完全反应,转移的电子数为 1mol×12×2×[(0-(-1)]=1mol,
故答案为:2CO2+2Na2O2═2Na2CO3+O2;1;
(3)G→E为稀硝酸和铜的反应,方程式为3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,用双线桥标出电子转移的方向和数目为: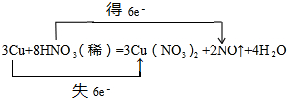 ,
,
故答案为: ;
;
(4)将等物质的量的NO、NO2混合气通入NaOH溶液中,恰好被吸收,生成一种钠盐,令该盐中N元素化合价为x,根据电子转移守恒可知:x-2=4-x,解得x=3,故生成NaNO2,该反应的化学方程式为:NO+NO2+2NaOH═2NaNO2+H2O,
故答案为:NO+NO2+2NaOH═2NaNO2+H2O;
(5)实验室里,检验NH4HCO3中阳离子的方法是:取少量X于试管中,加入NaOH溶液,然后加热试管,再将湿润的红色石蕊试纸放在试管口,放出的气体能使湿润的红色石蕊试纸变蓝,则可说明其中有铵根离子,
故答案为:取少量X于试管中,加入NaOH溶液,然后加热试管,再将湿润的红色石蕊试纸放在试管口,放出的气体能使湿润的红色石蕊试纸变蓝,则可说明其中有铵根离子;
(6)120℃时,NH4HCO3完全分解生成NH3、H2O(气体)、CO2的物质的量之比为1:1:1,故混合产物的平均相对分子量=793=26.3,
故答案为:26.3.
本题解析:
本题难度:一般
3、推断题 已知有机物A、B、C、D、E、F有以下转化关系。A的产量是衡量一个国家石油化工生产水平的标志;D能使石蕊试液变红;E是不溶于水且具有水果香味的无色液体,相对分子质量是C的2倍;F是塑料的主要成分之一,常用于制食品包装袋。结合下图关系回答问题:

⑴按要求回答下列问题:
①写出A、E的结构简式:A??、E??;
②写出B、C、D、E中官能团的名称:B?、C、?D?E、?;
③写出反应②的反应方程式:?
(2)A与苯都是石油化工的重要产品,在一定条件下A可以转化生成苯,按要求回答下列问题:
①苯可以发生取代反应,写出由苯制备溴苯的化学反应方程式:?
②纯净的溴苯是无色油状液体,实验室制得的粗溴苯通常因溶解了Br2呈褐色,可以加入试剂?
除去,反应方程式为?,该除杂操作所必须的主要玻璃仪器是?。
参考答案:(16分)(1)①A、 CH2=CH2(2分)E 、CH3COOC2H5;(2分)
②B、羟基;C、醛基;D、羧基;E、酯基?(每空各1分)
③2CH3CH2OH+O2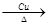 2CH3CHO+2H2O(2分,未配平和反应条件得1分,结构简式写错0分)
2CH3CHO+2H2O(2分,未配平和反应条件得1分,结构简式写错0分)
(2)①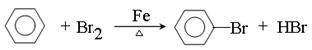 ?(2分,结构简式写错0分)
?(2分,结构简式写错0分)
②Br2+2NaOH=NaBr+NaBrO+H2O(2分,未配平扣1分,合理答案均给分);分液漏斗(2分,填漏斗、长颈漏斗不给分)
本题解析:A的产量是衡量一个国家石油化工生产水平的标志,则A是乙烯。乙烯含有碳碳双键,和水发生加成反应生成乙醇,即B是乙醇。乙醇发生催化氧化生成C,则C是乙醛。乙醇直接被氧化生成乙酸,即D是乙酸,乙醇和乙酸发生酯化反应生成乙酸乙酯,即E是乙酸乙酯。乙烯含有碳碳双键,能发生加聚反应生成聚乙烯,即F是聚乙烯。
(1)①乙烯和结构简式是CH2=CH2,乙酸乙酯的结构简式是CH3COOC2H5。
②乙醇、乙醛、乙酸和乙酸乙酯中的官能团分别是羟基、醛基、羧基、酯基。
③反应②是乙醇的催化氧化,则反应的化学方程式是2CH3CH2OH+O2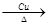 2CH3CHO+2H2O。
2CH3CHO+2H2O。
(2)①在催化剂的作用下,苯和液溴发生取代反应生成溴苯,反应的化学方程式是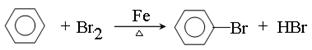 ?。
?。
②单质溴能被氢氧化钠溶液吸收,所以除去溴苯中溴的试剂是氢氧化钠,反应的化学方程式是Br2+2NaOH=NaBr+NaBrO+H2O;溴苯不溶于水,直接分液即可,主要玻璃仪器是分液漏斗。
点评:该题是中等难度试题的考查,涉及烯、醇、酯、苯和溴苯等性质与转化,难度不大,是对有机知识的综合运用。有机推断是高考中的常见题型,每年高考中必考,经常给出某反应信息要求学生加以应用,能较好的考查考生的阅读、自学能力和思维能力,是热点题型,需要重点掌握。该题的突破点是乙烯。
本题难度:一般
4、填空题 (6分)室温下,单质A.B、C分别为金属单质、黄绿色气体、无色气体,在一定的条件下,它们可以按下列框图进行反应。又知D溶液是黄色的。请回答:
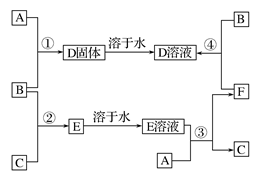
(1)写出下列物质的化学式:A________________,B____________。
(2)反应①的化学方程式:________________________________。
(3)反应④的离子方程式:________________________________。
参考答案:(6分) (1)Fe? ? Cl2 ?(每空1分)
(2)2Fe+3Cl2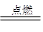 2FeCl3?(2分)
2FeCl3?(2分)
(3) 2Fe2++Cl2===2Fe3++2Cl-?(2分)
本题解析:本题是无机框图题,关键是找准突破点。单质A.B、C分别为金属单质、黄绿色气体、无色气体,所以B一定是氯气,则C应该是氢气,E是氯化氢。又知D溶液是黄色的,所以D是氯化铁,则A是铁。铁与盐酸反应又生成氢气和氯化亚铁,氯化亚铁被氯气氧化则生成氯化铁,即F是氯化亚铁。
本题难度:一般
5、简答题 物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中气体D、E为单质,试回答:

(1)A元素的原子结构示意图为______.
(2)写出下列物质的化学式:E是______,K是______.
(3)化合物B属于______化合物(填“离子”或“共价”).
(4)实验室检验J中所含的金属离子时,常在J的溶液中加入______溶液.
(5)写出反应“F→G”的化学方程式:______;
(6)写出反应“I→J”的离子方程式:______.
参考答案:K为红褐色沉淀,则应为Fe(OH)3,则溶液J中含有Fe3+,所以H为Fe,D应为H2,E应为Cl2,B为HCl,则I为FeCl2,J为FeCl3,K为Fe(OH)3,白色沉淀F能溶于过量NaOH溶液,则F为Al(OH)3,G为NaAlO2,A为Al,C为AlCl3,
(1)A为Al,原子核外有3个电子层,最外层电子数为3,则原子结构示意图为

,
故答案为:

;
(2)由以上分析可知E为Cl2,K为Fe(OH)3,故答案为:Cl2;Fe(OH)3;
(3)B为HCl,为共价化合物,故答案为:共价;
(4)J为FeCl3,加入硫氰化钾发生颜色反应,溶液呈红色,加入氢氧化钠溶液,生成氢氧化铁红褐色沉淀,
故答案为:硫氰化钾溶液或氢氧化钠溶液;
(5)F为Al(OH)3,G为NaAlO2,反应“F→G”的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O,
故答案为:Al(OH)3+NaOH=NaAlO2+2H2O;
(6)I为FeCl2,J为FeCl3,反应“I→J”的离子方程式为2Fe2++Cl2=2Fe2++2Cl-,
故答案为:2Fe2++Cl2=2Fe2++2Cl-.
本题解析:
本题难度:一般