微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 [化学---物质结构与性质]研究物质的微观结构,有助于人们理解物质变化的本质.请回答下列问题.
(1)P、S、Cl三种元素中,第一电离能最小的是______.
(2)PCl3和CH4中心原子的杂化类型相同,PCl3分子的空间构型是______.
(3)钛原子的电子排布式为______.在浓的TiCl3溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3?6H2O的绿色晶体,将1mol该物质溶于水,加入足量硝酸银溶液,立即产生1mol氯化银沉淀,则该配合物阳离子的化学式为______,形成该离子时提供孤电子对的分子或离子是______(填化学式).
(4)铁元素在1183K以下形成的晶体的基本结构单元如图1所示,1183K以上转变为图2所示结构的基本结构单元.两种晶体的基本结构单元中的原子个数之比为______.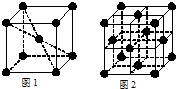
参考答案:(1)同周期元素从左到右元素的第一电离能逐渐增大,则Cl的第一电离能大于S,由于P元素的3p轨道为半充满状态,处于稳定状态,则P的第一电离能大于S,所以最小的是S,故答案为:S;
(2)PCl3中含有3个δ键和1个孤电子对,应为三角锥形,故答案为:三角锥形;
(3)Ti的原子序数为22,位于周期表第四周期ⅣB族,原子核外电子排布式为1s22s22p63s23p63d24s2,在浓的TiCl3溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3?6H2O的绿色晶体,将1mol该物质溶于水,加入足量硝酸银溶液,立即产生1mol氯化银沉淀,说明有2molCl-与Ti3+形成配位键,形成的配离子为[TiCl2(H2O)4]+,
形成该离子时提供孤电子对的分子或离子是H2O、Cl-,
故答案为:1s22s22p63s23p63d24s2;[TiCl2(H2O)4]+;H2O、Cl-;
(4)图1中Fe原子位于顶点和体心,晶胞中含有1+8×18=2个Fe原子,
图2中Fe原子位于顶点和面心,晶胞中含有6×12+8×18=4个Fe原子,
所以两种晶体的基本结构单元中的原子个数之比为2:4=1:2,
故答案为:1:2.
本题解析:
本题难度:简单
2、选择题 下列关于氢原子电子云图的说法正确的是( )
A.通常用小黑点来表示电子的多少,黑点密度大,电子数目大
B.黑点密度大,单位体积内电子出现的机会大
C.通常用小黑点来表示电子绕核作高速圆周运动
D.电子云图是对运动无规律性的描述
参考答案:B
本题解析:
本题难度:一般
3、填空题 Ga和As在一定条件下可以合成GaAs,GaAs是一种新型化合物半导体材料,其性能比硅更优越.多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等.
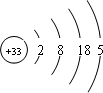
(1)Ga在元素周期表的位置是______,As的原子结构示意图______.
(2)Ga的原子核外电子排布式为:______.
(3)GaCl3和AsF3的空间构型分别是:GaCl3______,AsF3______.
(4)第IV?A族的C和Si也可以形成类似的化合物半导体材料SiC,其结构跟金刚石相似,则SiC属于______晶体,并写出其主要的物理性质______?(任2种).
(5)第一电离能:As______Se(填“>”、“<”或“=”).
(6)硫化锌的晶胞中(结构如图所示),硫离子的配位数是______.
(7)二氧化硒分子的空间构型为______,写出它的1个等电子体的分子式______.
参考答案:(1)Ga原子的原子结构示意图中,有四个电子层,最外层有3个电子,所以其属于第四周期第IIIA族,As是33号元素,其原子结构示意图为
;
故答案为:第四周期第IIIA族,

;
?(2)Ga是31号元素,所以Ga的原子核外电子排布式为1s22s22p63s23p63d104s24p1;
故答案为:1s22s22p63s23p63d104s24p1;
(3)GaCl3中价层电子对个数=3+12(3-3×1)=3,且没有孤电子对,所以其空间构型是平面三角形结构;
AsF3中价电子对个数=3+12(5-3×1)=4,有一个孤电子对,所以其空间构型是三角锥形;
故答案为:平面三角形,三角锥;
(4)SiC的结构跟金刚石相似,金刚石是原子晶体,则碳化硅是原子晶体,原子晶体的熔点高、硬度大;
故答案为:原子,硬度大、熔点高;
(5)同一周期中,第VA族元素第一电离能大于第VIA元素,As 和Se属于同一周期,As是第VA元素,Se是第VIA元素,所以第一电离能As>Se;
故答案为:>;
(6)根据图片知,每个S离子连接4个Zn离子,所其配位数是4;
故答案为:4;
(7)二氧化硒分子中价电子对个数=2+12(6-2×2)=3,含有一个孤电子对,所以其空间构型是V形,等电子体中含有相同的价电子数且原子个数相等,如果把硒原子换成氧原子或硫原子,二氧化硒变成臭氧或二氧化硫,其价电子数和原子个数都相等,所以是等电子体;
故答案为:V形,O3(或SO2).
本题解析:
本题难度:一般
4、填空题 下表列出了核电荷数为21~25的元素的最高正化合价,回答下列问题

(1)写出下列元素基态原子的核外电子排布式:
Sc____________________________ Ti_______________________________
V ____________________________ Mn ______________________________
(2)已知基态铬原子的电子排布是1s22s22p63s23p63d54s1,并不符合构造原理。人们常常会碰到客观事实与理论不相吻合的问题,当你遇到这样的问题时,你的态度是 ____________________________。
(3)对比上述五种元素原子的核外电子排布与元素的最高正化合价,你发现的规律是____________________________________;出现这一现象的原因是_________________________________。
参考答案:(1)Sc:1s22s22p63s23p63d14s2或[Ar]3d14s2;Ti:1s22s22p63s23p63d24s2或[Ar]3d24s2
V:1s22s22p63s23p63d34s2或[Ar]3d34s2;Mn:1s22s22p63s23p63d14s23d54s2或[Ar]3d54s2
(2)尊重客观事实,注重理论适用范围,掌握特例(答案合理即可)
(3)五种元素的最高正化合价数值等于各元素基态原子的最高能层s电子和次高能层d电子数目之和;
能量交错使得d电子也参与了化学反应
本题解析:
本题难度:一般
5、选择题 某电子层当它作为最外层时,最多只能容纳8个电子,当它作为次外层时,最多只能容纳18个电子,该电子层可能是( )
A.M层
B.K层
C.L层
D.P层
参考答案:AD
本题解析:
本题难度:一般