微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列溶液中含Cl-浓度最大的是
A.5m1、0.1mol?L-1的AlCl3溶液
B.10m1、0.1mo1?L-1的CaCl2溶液
C.20m1、0.2mo1?L-1的KCl溶液
D.50m1、0.25mo1?L-1的NaC1溶液
参考答案:A
本题解析:分析:溶液中离子的浓度和溶液的浓度大小有关,而和溶液的体积的大小无关.
解答:根据电离方程式,电离出的离子和溶质的量之间的关系来确定.
A、0.1mol?L-1的AlCl3溶液中氯离子浓度是0.3mol/L;
B、0.1mo1?L-1的CaCl2溶液中氯离子浓度是0.2mol/L;
C、0.2mo1?L-1的KCl溶液中氯离子浓度是0.2mol/L;
D、0.25mo1?L-1的NaCl溶液中氯离子浓度是0.25mol/L,
显然氯离子浓度最大的是0.3mol/L.
故选A.
点评:本题考查学生有关离子浓度大小的计算知识,是一道基础知识题目,较简单.
本题难度:简单
2、选择题 下列有机化合物分子中,在氢核磁共振谱中只给出一种信号的是
[? ]
A. ?
?
B.CH3CH2CH3?
C.CH3COOCH3?
D.C(CH3)4
参考答案:D
本题解析:
本题难度:一般
3、选择题 100毫升0.3摩尔/升Na2SO4溶液和50毫升0.2摩尔/升Al2(SO4)3溶液混合后,溶液中SO42-离子的物质的量浓度为
A.0.20摩尔/升
B.0.25摩尔/升
C.0.40摩尔/升
D.0.50摩尔/升
参考答案:C
本题解析:分析:100毫升0.3摩尔/升Na2SO4溶液和50毫升0.2摩尔/升Al2(SO4)3溶液混合后,Na2SO4 与 Al2(SO4)3 混合后不发生反应,故混合溶液中各物质的量是不变的,根据公式c=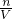 来计算微粒的物质的量浓度.
来计算微粒的物质的量浓度.
解答:100毫升0.3摩尔/升Na2SO4溶液和50毫升0.2摩尔/升Al2(SO4)3溶液混合后,Na2SO4 与 Al2(SO4)3 混合后不发生反应,故混合溶液中各物质的量是不变的,Na2SO4的物质的量为 0.1mL×0.3mol/L=0.03 mol,则(SO4)2-的物质的量为0.03 mol,Al2(SO4)3 的物质的量为:0.05mL×0.2mol/L=0.01 mol,,则(SO4)2-的物质的量为 3×0.01mol=0.03 mol,所以混合后溶液中(SO4)2-的物质的量为0.03mol+0.03mol=0.06mol,混合后溶液的体积可以粗略认为是两溶液混合后体积之和,根据公式c=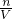 =
=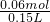 =0.40mol/L,故硫酸根的物质的量浓度为0.40 mol/L,
=0.40mol/L,故硫酸根的物质的量浓度为0.40 mol/L,
故选C.
点评:本题考查物质的量浓度的计算,可以根据公式来计算,是一道基础知识题目.
本题难度:一般
4、选择题 等物质的量的氢气和氦气具有相同的
A.质量
B.摩尔质量
C.分子数
D.体积
参考答案:C
本题解析:分析:根据m=nM、N=nNA、V=nVm确定质量、分子数和体积的相对大小,注意温度不同气体摩尔体积不同,且在数值上,摩尔质量等于其相对分子质量.
解答:A.氢气的摩尔质量是2g/mol,氦气的摩尔质量是4g/mol,根据m=nM知,等物质的量的氢气和氦气,其质量不同,故A错误;
B.氢气的摩尔质量是2g/mol,氦气的摩尔质量是4g/mol,所以其摩尔质量不同,故B错误;
C.根据N=nNA知,只要是物质的量相对的气体,其分子数就相对,故C正确;
D.气体摩尔体积与温度和压强有关,温度和压强未知,导致无法判断其体积大小,故D错误;
故选C.
点评:本题考查了有关物质的量的计算,易错选项是D,有关气体体积的计算中一定要注意温度和压强,温度和压强不同则气体摩尔体积不同,为易错点.
本题难度:简单
5、选择题 下列离子检验方法和结论相符的一组是
A.A
B.B
C.C
D.D
参考答案:D
本题解析:分析:A.向一种未知溶液中加入BaCl2溶液,有白色沉淀生成,沉淀可能是AgCl或BaSO4沉淀;
B.Fe3+与SCN-反应生成红色物质,但Fe2+与SCN-不反应;
C.加入的盐酸也会与硝酸银反应生成氯化银沉淀;
D.可能为HCO3-;
解答:A.向一种未知溶液中加入BaCl2溶液,有白色沉淀生成,沉淀可能是AgCl或BaSO4沉淀,溶液中可能含有Cl-或SO42-离子,故A错误;
B.向一种未知溶液中滴加KSCN溶液,溶液变为红色,说明Fe3+与SCN-反应生成红色物质,必存在Fe3+,但Fe2+与SCN-不反应,不能肯定Fe2+的存在与否,故B错误;
C.先加适量的盐酸将溶液酸化,再加AgNO3溶液,产生了白色沉淀.加入的盐酸也会生成沉淀,溶液中不一定含有大量的Cl-,故C错误;
D.CO32-和HCO3-都能与HCl反应生成CO2气体,CO2气体为能使澄清石灰水变浑浊的无色无味的气体,所以不能判断出是否含有CO32-,故D正确;
故选D.
点评:本题考查物质的检验、鉴别、反应现象的判断,解题关键是干扰离子的分析判断,题目难度中等.
本题难度:困难