微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 A、B均为短周期金属元素。依据下表数据判断一定错误的是
电离能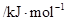
| 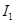
| 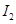
| 
| 
|
A
| 932
| 1821
| 15390
| 21771
|
B
| 738
| 1451
| 7733
| 10540
|
A.A元素的常见价态是是+2价? B.A的最高价氧化物的水化物可能是两性氢氧化物
C.电负性:A>B? D.B原子的电子排布式为1s2 2s2
参考答案:D
本题解析:对于A元素原子:I1:I2≈1:2,而I2:I3≈1:9即可知A元素原子的易失去2个电子;对于B元素原子:I1:I2≈1:2,而I2:I3≈1:7即可知B元素原子的易失去2个电子,A、B为第IIA元素,由A的I1>B的I1:即A为Be元素,B为Mg元素;
A正确,Be元素常见价态是是+2价;
B正确,氢氧化铍,具有两性属于两性氧化化物;
C正确,正确,同主族元素,从上到下元素的非金属性逐渐减弱,电负性逐渐减弱;
D错,B为镁原子,电子排布式为1s2 2s22p6 3s2
本题难度:一般
2、填空题 (12分)A、B、C、D、E、F均为元素周期表前20号主族元素,其核电荷数依次增大。其中A、B同周期,B、D同主族且相邻,A、B、D三种元素的核电荷数之和为30。C、E同周期,可形成1:1型的离子化合物。F的最外层电子数大于1。请回答:
(1)A、B、C、D、E、F六种元素的元素符号分别为_______________________?__;
(2)用化学式表示A、D、E最高价氧化物的水化物酸性由强到弱的顺序:_______;
(3)用化学式表示D、E氢化物的还原性由强到弱的顺序:_______;
(4)请写出C、E最高价氧化物对应水化物之间反应的化学方程式:________________。
参考答案:(共12分)(1)C、O、Na、S、Cl、Ca (各1分)(2)HClO4>H2SO4>H2CO3 ?(2分)(3)H2S> HCl(2分)?(4)HClO4 + NaOH ==NaClO4 + H2O(2分)
本题解析:B、D同主族且相邻,则B是第二周期,D是第三周期。C、E同周期,可形成1:1型的离子化合物,则该化合物应该是氯化钠或硫化镁。如果是硫化镁,则BD的原子序数之和就≤22,则A的原子序数最小是8,这和A的原子序数小于B的矛盾,所以C是钠,E是氯,则A是碳,B是氧元素,D是硫元素,F是钙。
(1)分别是C、O、Na、S、Cl、Ca。
(2)非金属性越强,最高价氧化物的水化物的酸性越强,非金属性是Cl>S>C,则酸性强弱顺序是HClO4>H2SO4>H2CO3。
(3)非金属性越强,相应氢化物的还原性越弱,所以还原性强弱顺序是H2S> HCl。
(4)C、E最高价氧化物对应水化物分别是强酸和强碱,方程式为HClO4 + NaOH ==NaClO4 + H2O。
本题难度:简单
3、选择题 X、Y、Z三种元素的原子,其最外层电子排布分别为ns1、3s23p1、2s22p4,由这三种元素组成的化合物的化学式可能是(? )
A.XYZ2
B.X2YZ3
C.X2YZ2
D.XYZ3
参考答案:A
本题解析:三元素分别为第IA族元素、Al、O元素,三者元素分别为+1、+3、—2价,符合条件的只有A,答案为A
本题难度:简单
4、填空题 (10分)在第3周期中,原子半径最大的金属元素是?,(填元素符号,下同)离子半径最小的离子是??,化学性质最稳定的元素是?,最高价氧化物对应水化物的酸性最强的化合物的化学式是?,最高价氧化物对应水化物的碱性最强的化合物的化学式是?,显两性的氢氧化物的化学式是?,该两性氢氧化物与盐酸、氢氧化钠溶液分别反应的离子方程式为?、?。
参考答案:Na 、 AI3+、 Ar 、? HClO4?、? NaOH?、?Al(OH)3;(每空1分)?Al(OH)3 +3H+ =Al3+ +3H2O?Al(OH)3 +3OH― =[Al(OH)4]-?(每空2分)
本题解析:考查元素周期律的应用。同周期元素自左向右,原子半径逐渐减小,阳离子半径和阴离子半径就是逐渐减小的。金属性逐渐减弱,非金属性逐渐增强。
本题难度:一般
5、选择题 下列物质属于纯净物的是
A.苯
B.天然气
C.汽油
D.煤
参考答案:A
本题解析:由同一种物质形成的是纯净物,同不同种物质形成的是混合物,苯是纯净物,其余都是混合物,答案选A。
本题难度:简单