| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《盐类水解的原理》高频试题预测(2017年最新版)(八)
参考答案:B 本题解析:四个选项中,均存在铵根的水解平衡; 本题难度:一般 2、选择题 HA为酸性略强于醋酸的一元弱酸.在0.1 mol·L-1 NaA溶液中,离子浓度关系正确的是 |
参考答案:C
本题解析:HA为酸性略强于醋酸的一元弱酸,NaA就是强碱弱酸盐,水解溶液显碱性c(OH-) > c(H+),A错;A-水解程度很小则c(A-) >c(OH-),B错;C是电荷守恒,对; D.应该是c(Na+)+c(OH-) >c(A-)+c(H+),D错。选C。
考点:溶液中离子浓度的大小比较和电荷守恒。
本题难度:一般
3、填空题 在配制Al2(SO4)3溶液时,铝离子会部分水解而使溶液呈酸性,水解的离子方程式为: 。为了防止发生水解,可以加入少量的 ;在Na2S溶液中,硫离子水解的离子方程是 ;为了防止水解,在配制该溶液时,可以加入少量的 。
参考答案:Al3+ +3H2O 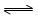 Al(OH)3+3H+ 稀硫酸
Al(OH)3+3H+ 稀硫酸 S2- + H2O
S2- + H2O 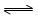 HS- + OH- 氢氧化钠
HS- + OH- 氢氧化钠
本题解析:略
本题难度:一般
4、简答题 硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:
SO2(g)+2CO(g)=2CO2(g)+1/xSx(s) △H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+3/xSx(s) △H=bkJ/mol。
则COS(g)生成CO(g)与Sx(s)反应的热化学方程式是 。
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:
As2S3+10H++ 10NO3?=2H3AsO4+3S+10NO2↑+ 2H2O,当生成H3AsO4的物质的量
为0.6 mol反应中转移电子的数目为 ,
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS?、S2?的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
①B表示 。
②滴加过程中,溶液中微粒浓度大小关系正确的是 (填字母)。 a.c(Na+)= c(H2S)+c(HS?)+2c(S2?)
a.c(Na+)= c(H2S)+c(HS?)+2c(S2?)
b.2c(Na+)=c(H2S)+c(HS?)+c(S2?)
c.c(Na+)=3[c(H2S)+c(HS?)+c(S2?)]
③NaHS溶液呈碱性,当滴加盐酸至M点时,溶液中各离子浓度由大到小的顺序为  (4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示: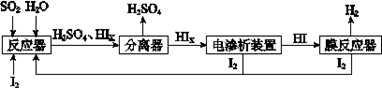
① 写出反应器中发生反应的化学方程式是 。
② 电渗析装置如右图所示,写出阳极的电极反应式 。该装置中发生的总反应的化学
参考答案:(1)xCOS(g)=XCO(g)+Sx(s)△H=0.5x(b-a)akJ/mol
(2)3NA
(3) ①HS-(或NaHS)
② c
③ c(Na+)>c(HS-)>c(S2-)>c(OH-)> c(H+)
(4)①SO2+xI2+2H2O=H2SO4+2HIx
②2Ix—-2e-=xI2 2HIx=(x-1)I2+2HI
本题解析:(1)①SO2(g)+2CO(g)=2CO2(g)+1/xSx(s) △H=akJ/mol
②2COS(g)+SO2(g)=2CO2(g)+3/xSx(s) △H=bkJ/mol。由盖斯定律可得,xCOS(g)=Xco(g)+Sx(s)△H=0.5x(b-a)akJ/mol;
(2)根据As2S3+10H++ 10NO3?=2H3AsO4+3S+10NO2↑+ 2H2O,若生成H3AsO4的物质的量为2mol时,电子转移为10mol,若生成H3AsO4的物质的量为0.6mol时,电子转移为3NA;
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量发生的反应依次为,NaOH+HCl=NaCl+H2O、Na2S+HCl=NaCl+NaHS、NaHS+HCl=H2S+NaCl。①结合图像分析,B表示HS-;②根据元素守恒知,滴加过程中,溶液中微粒浓度大小关系为c(Na+)=3[c(H2S)+c(HS?)+c(S2?)],选c;③A表示Na2S,B表示NaHS,当滴加盐酸至M点时,表示两者含量相等,溶液中
c(Na+)=3[c(H2S)+c(HS?)+c(S2?)],则c(Na+)>c(HS-),NaHS溶液呈碱性,说明其水解大于电离,水解是微弱的,所以c(HS-)>c(S2-),硫化钠为强碱弱酸盐,其溶液呈碱性,所以c(OH-)>c(H+),则c(Na+)>c(HS-)>c(S2-)>c(OH-)> c(H+);
(4)由工艺流程图可知,SO2、I2、H2O反应生成H2SO4、HIX,反应方程式为:SO2+xI2+2H2O=H2SO4+2HIX;②由题给装置图可知,在阴极区Ix-转化为I-,在阳极区Ix-转化为I2,所以阳极区发生的反应为:2Ix--2e-=xI2,电解HIx生成I2、HI,反应方程式为:2HIx
本题难度:一般
5、选择题 25℃时,下列有关溶液中微粒的物质的量浓度关系不正确的是
A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液中:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)
B.pH =11的氨水和pH=3的盐酸溶液等体积混合,所得溶液中:c(Cl-)>c(NH4+)> c(OH-)>c(H+)
C.0.1 mol·L-1 CH3COONa溶液中:c(CH3COO-)+c(CH3COOH) =" 0.1" mol·L-1
D.0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后溶液显酸性 c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
参考答案:B
本题解析:A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液中,由于铵根离子会发生水解反应消耗,所以c(SO42-)>c(NH4+);根据物料守恒可知:c(NH4+)>c(Fe2+);铵根离子、亚铁离子水解消耗水电离产生的OH-,破坏了水的电离平衡,最终使溶液显酸性,所以c(H+)> c(OH-);但是盐的水解程度是微弱的,盐电离产生的离子浓度大于水电离产生的离子浓度,所以c(Fe2+)>c(H+)。故溶液中离子的浓度关系是:c(SO42-)> c(NH4+) > c(Fe2+)>c(H+),正确;B.一水合氨是弱碱,当pH =11的氨水和pH=3的盐酸溶液等体积混合时,弱碱电离产生的离子恰好与盐酸中和,未电离的碱的分子会继续电离,所以溶液显碱性,c(OH-)>c(H+);c(NH4+)>c(Cl-),但是强电解质盐电离产生的离子浓度大于弱电解质一水合氨的电离,所以c(Cl-)> c(OH-),故离子浓度关系是:所得溶液中:c(NH4+)>c(Cl-)> c(OH-)>c(H+),错误;C.根据物料守恒可得在0.1 mol·L-1 CH3COONa溶液中:c(CH3COO-)+c(CH3COOH) =" 0.1" mol/L, 正确;D.0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后所得溶液是CH3COOH和CH3COONa等物质的量的混合溶液。因为溶液显酸性 说明醋酸的电离作用大于CH3COO-水解作用,所以c(CH3COO-)>c(Cl-) >c(CH3COOH),酸的电离作用是微弱的,所以c(CH3COOH)>c(H+),因此微粒浓度关系是c(CH3COO-)>c(Cl-) >c(CH3COOH) >c(H+),正确。
考点:考查溶液中微粒的物质的量浓度关系的知识。
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《绿色化学》.. | |