微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 以下实验装置一般不用于分离物质的是
[? ]
A.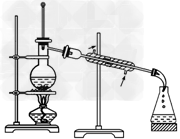
B.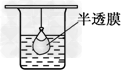
C.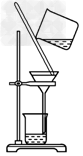
D.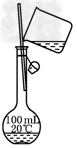
参考答案:D
本题解析:
本题难度:简单
2、填空题 除去以下物质中含有的杂质(括号内为杂质),写出除杂的试剂(若不需要试剂,则可用“/”表示)及分离方法。
示例:CO2(SO2)试剂 饱和NaHCO3溶液 ,分离方法 洗气 。
请按上述示例完成下列各小题:
(1)硝酸钾晶体(氯化钠)试剂________________,分离方法_________;
(2)自来水(杂质Fe3+等)试剂________________,分离方法__________;
(3)提取溴水中的溴单质 ? 试剂________________,分离方法___________;
(4)氯化亚铁溶液(氯化铁)试剂_____________,分离方法___________。
参考答案:(1)蒸馏水;结晶
(2)/;蒸馏
(3)CCl4;萃取
(4)铁粉;过滤
本题解析:
本题难度:一般
3、选择题 下列分离或提纯物质的方法错误的是
[? ]
A.用渗析的方法精制氢氧化铁胶体
B.用加热的方法提纯含有少量碳酸氢钠的碳酸钠
C.用溶解、过滤的方法提纯含有少量硫酸钡的碳酸钡
D.用盐析的方法分离、提纯蛋白质
参考答案:C
本题解析:
本题难度:简单
4、选择题 在分析某些溶液中的离子成分时,为了排除其他离子可能的干扰,通常先在溶液中 加入一些试剂对干扰离子进行掩蔽以得到准确的结果。下列掩蔽方法和分析结果正确的是
A.某溶液中滴加KSCN溶液呈无色,再滴加氯水后出现血红色,该溶液中含有Fe2+
B.某溶液中滴加NaOH溶液后再滴加CaCl2溶液出现白色 沉淀,该溶液中含有CO32-
C.溶液中滴加氨水后再滴加NaOH溶液出现白色沉淀,该溶液中含有Al3+
D.某溶液中滴加足量稀盐酸后,再滴加BaCl2溶液才出现白色沉淀,该溶液中含有SO42-
参考答案:AD
本题解析:B不正确,因为也可能含有HCO3-,这是由于HCO3-能和氢氧化钠反应生成CO32-;C不正确,也可能含有镁离子等,因为氢氧化铝虽然是两性氢氧化物,但不能溶于氨水中,其余选项都是正确的,答案选AD。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,有助于培养学生规范、严谨的实验设计能力,提高学生的学科素养。该类试题学生需要明确的是进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可。
本题难度:简单
5、简答题 某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、Fe3+、Al3+、Cu2+、Mg2+):

常温下部分阳离子以氢氧化物沉淀形式存在时溶液的pH见表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+
开始沉淀时的pH
1.9
7.0
9.3
3.7
4.7
---
沉淀完全时的pH
3.2
9.0
11.1
8.0
6.7
9(>9溶解)
|
(1)酸浸时,为了提高浸取效率可采取的措施是______(至少写一条).
(2)加入H2O2目的是氧化______离子,其有关的离子方程式______(写一种).针铁矿(Coethite)是以德国诗人歌德(Coethe)名字命名的,组成元素是Fe、H、O,化学式量为89,其化学式是______.
(3)调pH=8是为了将______离子(从Fe3+、Al3+、Cu2+、Mg2+中选择)以氢氧化物沉淀的形式除去.滤出的沉淀中部分沉淀将溶解于足量的氢氧化钠溶液中,其有关的离子方程式是______,取少量上层澄清溶液,向其中通入足量的CO2,又能重新得到相应的沉淀,其有关的离子方程式为______.
(4)试配平最后一步相关的氧化还原方程式:
______Na2Cr2O7+______SO2+______H2O=______Cr(OH)(H2O)5SO4+______Na2SO4,每生成1molCr(OH)(H2O)5SO4时,该反应中转移的电子数为______.
参考答案:(1)酸浸时,为了提高浸取率可采取的措施是:增加浸取时间、不断搅拌混合物、滤渣多次浸取等,
故答案为:升高温度、搅拌、延长浸取时间、过滤后再次浸取;
(2)双氧水有强氧化性,能氧化还原性的物质,Fe2+和Cr3+有还原性,Fe2+和Cr3+能被双氧水氧化为高价离子,以便于与杂质离子分离,
其中Fe2+反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,针铁矿组成元素是Fe、H、O,化学式量为89,则1mol该物质中应含有1molFe,则H、O的质量为89-56=33,可知应含有2molO和1molH,化学式应为FeO(OH),
故答案为:Fe2+;2Fe2++H2O2+2H+=2Fe3++2H2O;FeO(OH);
(3)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,由于Fe3+以针铁矿形成已经沉淀,则加入NaOH溶液使溶液呈碱性,溶液PH=8,Al3+、Cu2+转化为沉淀除去,滤出的沉淀中部分沉淀将溶解于足量的氢氧化钠溶液中,涉及反应为Al(OH)3+OH-=AlO2-+2H2O,
取少量上层澄清溶液,向其中通入足量的CO2,又能重新得到相应的沉淀,涉及反应为AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-,
故答案为:Al3+、Cu2+;Al(OH)3+OH-=AlO2-+2H2O;AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-;
(4)二氧化硫具有还原性,被滤液Ⅱ中通过离子交换后的溶液中Na2Cr2O7氧化为硫酸,Na2Cr2O7氧被还原为CrOH(H2O)5SO4,水溶液中生成硫酸反应生成硫酸钠,依据原子守恒分析书写配平方程式为Na2Cr2O7+3SO2+11H2O═2CrOH(H2O)5SO4↓+Na2SO4,
由方程式可知,Cr元素化合价降低3价,则每生成1mol Cr(OH)(H2O)5SO4时,转移3NA电子,
故答案为:1;3;11;2;1;3NA.
本题解析:
本题难度:一般