微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列选项的括号内是除 去杂质所用的试剂,其中错误的是
去杂质所用的试剂,其中错误的是
A.二氧化氮中混有NO( 水)
水)
B.NaNO3溶液中混有Na2SO4(Ba(NO3)2)
C.氯气中混有水蒸气(浓 硫酸)
硫酸)
D.氨气中混有水蒸气(碱石灰固体)
参考答案:A
本题解析:略
本题难度:一般
2、选择题 设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,11.2L四氯化碳中含有的C-Cl键的个数为2NA
B.1mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA
C.常温下,0.2mol Cl2溶于等体积水中,转移电子数为0.2NA
D.1L 0.1mol?L-1氨水溶液中所含的离子和分子总数为0.1NA
参考答案:B
本题解析:分析:A、依据气体摩尔体积的条件应用分析判断;
B、依据氧化钠和过氧化钠的结构分析判断;
C、依据氯气的溶解性不大,不能全部反应分析判断;
D、依据元素守恒分析判断,结合水溶液中含有水电离出的氢离子和氢氧根离子.
解答:A、标准状况下四氯化碳不是气体,11.2L四氯化碳物质的量不是0.5mol,故A错误;
B、1mol Na2O中含2mol Na+和1mol O2-,共3 mol离子;1mol Na2O2中含2mol Na+和1mol O22-,共含3mol离子;所以1mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA,故B正确;
C、0.2mol Cl2溶于等体积水中,少量溶解于水,部分和水反应发生氧化还原反应,所以转移电子数一定小于0.2NA,故C错误;
D、1L 0.1mol?L-1氨水溶液中所含的含氮元素的离子和分子总数为0.1NA,溶液中含有氢离子、氢氧根离子和水分子,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的应用,主要考查气体摩尔体积的条件应用,离子化合物的构成判断,氧化还原反应的电子转移计算,溶液中的分子离子数的计算.
本题难度:简单
3、选择题 为提纯下列物质(括号中为杂质),所选除杂试剂和分离方法都正确的是
[? ]
被提纯的物质(杂质)
除杂试剂
分离方法
A.
NH3(H2O)?
浓硫酸
洗气
B.
乙酸乙酯(乙酸)?
饱和碳酸钠溶液
分液
C.
KCl固体(I2)?
KOH溶液
加热
D.
苯(苯酚)
?浓溴水
过滤
参考答案:B
本题解析:
本题难度:一般
4、选择题 等物质的量的CH4和NH3相比较,下列结论不正确的是
A.原子个数之比为5:4
B.氢原子个数之比为4:3
C.分子个数之比为16:17
D.质量比为16: 17
参考答案:C
本题解析:试题分析:甲烷含有1个碳原子和4个氢原子。氨气含有1个氮原子和3个氢原子。所以在物质的量相等的条件下,分子个数之比为1:1,C不正确,其余选项都是正确的,答案选C。
考点:考查物质的量的有关计算
点评:该题是基础性试题的考查,难度不大。该题的关键是明确组成分子的原子个数,然后结合阿伏加德罗定律灵活运用即可,有助于培养学生分析问题、解决问题的能力。
本题难度:简单
5、填空题 工业上以碳酸锰矿为主要原料生产MnO2的工艺流程如下:
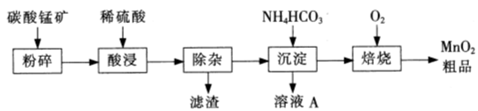
有关氢氧化物开始沉淀和沉淀完全的pH如下表:

请问答下列问题:?
(1)酸浸前将碳酸锰矿粉碎的作用是??。
(2)酸浸后的溶液中含有Mn2+、 SO42-,另含有少量Fe2+、Fe3+.A13+、Cu2+、Pb2+等,其除杂过程如下:
①加入MnO2将Fe2+氧化,其离子反应方程式为 ?。?
②加入CaO将溶液的pH调到5.2~6.0,其主要目的是 ??。
③加入BaS,除去Cu2~、Pb2+后,再加入NaF溶液,除去 ?。
(3)从溶液A中回收的主要物质是?,该物质常用作化肥。?
(4)MnO2粗品中含有少量Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,然后再用氧化剂将Mn2+转化为MnO2,制得优质MnO2。写出Mn3O4与稀硫酸反应韵化学方程式:
??。
参考答案:
(1)增大接触面积,加快反应速率(使反应更充分)
(2)@2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O?②除去Fe3~,A13+?③Ca2+
(3)(NH4)2SO4 ?
(4)Mn3O4+2H2SO4=2MnSO4+MnO2+2H2O? (每空2分,本题共12分)
本题解析:化工流程题,(1)将反应物粉碎的作用是增大接触面积,加快反应速率,使反应更充分;(2)pH调到5.2~6.0,其主要目的是除去Fe3~A13+和部分Cu2+;③溶液中除去Fe2+、Fe3+、A13+、Cu2+、Pb2+,但第②加入了Ca2+,再加入NaF溶液,显然是除去Ca2+;(3)流程得到的是碳酸锰沉淀,溶液中主要剩余NH4+和SO42-,故回收的物质是(NH4)2SO4 。
本题难度:困难