微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列装置工作时,将电能转化为化学能的是
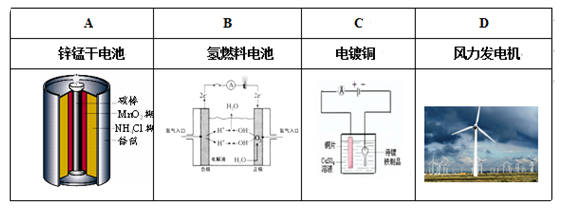
参考答案:C
本题解析:A、是将化学能转变为电能,不选A;B、是化学能变电能,不选B;C、是电镀池,电能变化学能,选C;D、风能变电能,不选D。
考点:原电池和电解池的原理,能量转化
本题难度:一般
2、填空题 (14分)高铁酸钠(Na2FeO4)是一种多功能、高效无毒的新型绿色水处理剂。
(1)Na2FeO4中铁元素的化合价是 价,Na2FeO4具有较强的 (填“氧化性”或“还原性”)。
(2)用Na2FeO4给水消毒、杀菌时得到的Fe3+可以净水,Fe3+净水原因是 (用离子方程式表示)。
(3)工业上可用FeCl3、NaOH 、NaClO三种物质在一定条件下反应制得Na2FeO4,完成下列化学方程式:2FeCl3 + 10NaOH + 3NaClO = 2 + 5 + 9 。
(4)工业上还可用电解浓NaOH溶液的方法制Na2FeO4 。
① 若电解所需的浓NaOH溶液为16 mol/L,则在实验室配制500 mL该浓度的溶液需NaOH g,配制过程所需玻璃仪器是 。
② 电解浓NaOH溶液制备Na2FeO4,其工作原理如下图所示:

阳极的电极反应式是 ;可循环使用的物质是 ,理由是 。
参考答案:(1)+6, 氧化性(各1分,共2分)(2)Fe3++3H2O  Fe(OH)3+3H+ (2分)
Fe(OH)3+3H+ (2分)
(3)Na2FeO4 H2O NaCl (2分) (4)① 320,烧杯、玻璃棒、500 mL容量瓶、胶头滴管
(计算2分,仪器答对2个给1分,答对4个给2分,没有500mL容量瓶扣1分) ②Fe-6e-+8OH-=FeO42-+4H2O(2分);NaOH溶液(1分);水电离的H+在阴极放电:2H++2e-=H2↑,c(OH-)增大,Na+通过阳离子交换膜进入阴极区,使阴极区c(NaOH)增大,故可以循环使用(1分)
本题解析:(1)Na2FeO4中钠和氧元素的化合价分别是+1价和—2价,则根据正负价代数和为0可知铁元素的化合价是+6价价。+6价的铁易得到电子,则Na2FeO4具有较强的氧化性。
(2)Fe3+在溶液中水解生成氢氧化铁胶体,胶体具有吸附性可以净水,反应的离子方程式表示为Fe3++3H2O  Fe(OH)3+3H+。
Fe(OH)3+3H+。
(3)根据方程式可知铁元素的化合价从+3价升高到+6价失去3个电子,氯元素的化合价从+1价降低到—1价,得到2个电子,则根据电子得失守恒可知氧化剂与还原剂的物质的量之比是3:2,所以根据质量守恒定律可知反应的化学方程式可表示为2FeCl3 + 10NaOH + 3NaClO=2 Na2FeO4+ 5H2O + 9 NaCl。
(4)①实验室配制500 mL该浓度的溶液需NaOH的质量是16mol/L×0.5L×40g/mol=320g。配制过程所需玻璃仪器是烧杯、玻璃棒、500 mL容量瓶、胶头滴管。
②电解池中阳极失去电子,则根据装置图可知阳极是铁电极,铁失去电子转化为高碳酸盐,阳极反应式为Fe-6e-+8OH-=FeO42-+4H2O;由于水电离的H+在阴极放电:2H++2e-=H2↑,c(OH-)增大,Na+通过阳离子交换膜进入阴极区,使阴极区c(NaOH)增大,故氢氧化钠可以循环使用。
考点:考查高碳酸盐的性质以及制备
本题难度:困难
3、填空题 如图所示,若电解5 min时,铜电极质量增加2.16 g。
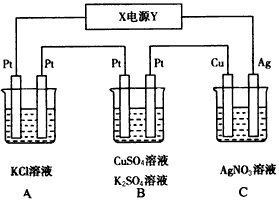
试回答:
(1)电源电极X名称为_______(填“正极”或“负极”)。
(2)电解池中溶液的pH变化:B_______,C_______(填“增大”“减小”或 “不变”)。
(3)B中的阳极的电极反应式为__________________;若通电5 min时B中共收集224 mL气体(标准状况)。
溶液体积为200 mL,则通电前硫酸铜溶液的物质的量浓度约为___________。
(4)A中发生反应的化学方程式为________________。若A中KCl溶液的体积也是200 mL,电解后溶液的pH=________。
(5)若将C装置单独取出,导线连接铜、银后,请写出负极的电极反应式________________
参考答案:(1)负极
(2)减小;不变
(3)4OH--4e-=O2↑+2H2O;0.025 mol/L
(4)2KCl+2H2O 2KOH+H2↑+Cl2↑;13
2KOH+H2↑+Cl2↑;13
(5)Cu-2e-=Cu2+
本题解析:
本题难度:一般
4、选择题 按下图的装置进行电解,A极是铜锌含金,B极为纯铜。电解质溶液中含有足量的Cu2+。 通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.03g,则A极合金中Cu、Zn的原子个数比为
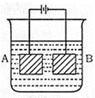
A.4:1
B.3:1
C.2:1
D.5:3
参考答案:B
本题解析:B是阴极,始终是铜离子放电析出铜。A是阳极,先是锌失去电子进入溶液,然后是铜失去电子,进入溶液。所以根据反应式Zn+Cu2++=Zn2++Cu可知每消耗1mol锌,溶液质量增加1g,所以合金中锌的物质的量是0.03mol,同时析出的铜也是0.03mol,质量是1.92g。所以合金中铜的质量是7.68g-1.92g=5.76g,物质的量是0.09mol,所以合金中Cu、Zn的原子个数比为3:1。答案选B。
本题难度:一般
5、选择题 下列叙述错误的是
A.生铁中含有碳,抗腐蚀能力比纯铁弱
B.用锡焊接的铁质器件,焊接处易生锈
C.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液
D.电解精炼铜时,电解质溶液中铜离子浓度减小