微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)在下图所示的装置A中,用KMnO4固体和浓盐酸混合制取Cl2,反应的离子方程式为:2MnO4—+10Cl—+16H+=2Mn2++5Cl2↑+8H2O;装置B中的四处棉花依次做了如下处理:①蘸有淀粉—KI溶液②蘸有品红溶液③蘸有紫色石蕊溶液④蘸有浓NaOH溶液。(图中夹持装置已略去)。
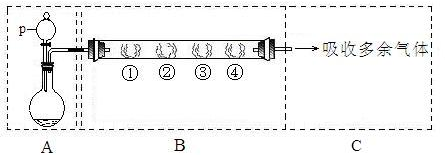
回答下列问题:
(1)p中盛装试剂的名称为?。
(2)反应开始后,观察到的实验现象是:
①处:?;
②处:?;
③处:?。
(3)写出④处反应的离子方式:?。
参考答案:(6分)(1)分液漏斗(1分
(2)①处:变蓝?(1分)
②处:褪色?(1分)
③处:(1分)?先变红后褪色(1分)
(3)Cl2+2OH—=Cl—+ClO-+H2O?(2分)
本题解析:考查氯气的制取及性质
(1)p装置为分液漏斗
(2)①处:Cl2+2I-=I2+2Cl-,碘使试纸呈蓝色
②处:氯气与水生成了具有漂白性的次氯酸:Cl2+H2O=HCl+HClO,故品红将褪色
③处:氯气与水生成了盐酸,使紫色石蕊试液变红,但迅速将被次氯酸漂白而褪色
(3)由于氯气有毒,必须进行尾气吸收,一般用碱液:Cl2+2OH—=Cl—+ClO-+H2O
本题难度:简单
2、选择题 一元硬币的外观有银白的金属光泽,一些同学认为它可能是铁制成的.在讨论时,有同学提出:“我们可以先拿磁铁来吸一下”.就“拿磁铁来吸一下”这一过程而言,属于科学探究中的( )
A.实验法
B.比较法
C.观察法
D.分类法
参考答案:A
本题解析:
本题难度:简单
3、实验题 Fe2O3、Cu2O都是红色粉末,常用作颜料。某校化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O溶于稀硫酸生成Cu和CuSO4;在空气中加热生成CuO。
提出假设:?
假设1:红色粉末是Fe2O3?
假设2:红色粉末是Cu2O
(1)假设3:?
设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 溶液。
(2)若假设1成立,则实验现象是?。
(3)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗??。
简述你的理由?。
(4)若固体粉末完全溶解无固体存在 , 滴加 KSCN 试剂时溶液不变红色 , 则证明原固体粉末是?,写出发生反应的离子方程式?、?、?。
探究延伸:经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(5) 实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b > a),则混合物中Cu2O的质量分数为?。
参考答案:(1)假设3:红色粉末是Fe2O3和Cu2O的混合物(1分)
(2)溶液变为血红色(1分)
(3)不合理? Cu能将Fe3+还原为Fe2+(2分)
(4)Fe2O3和Cu2O的混合物?
Fe2O3+6H+ = 2Fe3++3H2O? Cu2O+2H+ =" Cu" + Cu2+ + H2O
2 Fe3+ + Cu =" 2" Fe2+ + Cu2+(每个1分,共4分)
(5)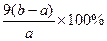 (1分)
(1分)
本题解析:略
本题难度:一般
4、实验题 某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成碳族元素中C与Si的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
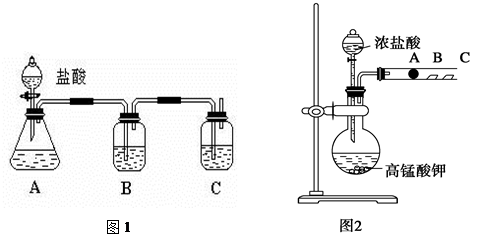
(1)甲同学设计实验的依据是
__________________________________________________________________;
写出选用物质的化学式:A____________,B_____________,C____________;
(2)其中装置B中所盛试剂的作用为_____________________________________;
C中反应的离子方程式为____________________________________________;
(3)乙同学的实验原理是_____________________________________________;
写出B处的离子方程式: ___________________________________________。
参考答案:(13分)(1)强酸制弱酸(2分);碳酸钙、饱和碳酸氢钠溶液、硅酸钠溶液(3分)
(2) 除去CO2中的氯化氢气体(2分;SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-(2分)
(3)强氧化剂生成弱氧化剂或活泼的非金属单质置换较不活泼的非金属单质(2分)
2I-+Cl2=2Cl-+I2(2分)
本题解析:(1)根据图①装置的特点可知,甲同学设计实验的依据是根据较强的酸制备减弱酸的原理进行设计的。A装置是制备CO2的,所以A中盛放的是碳酸钙,C盛放的是硅酸钠溶液。由于盐酸易挥发,也能和硅酸钠反应,生成硅酸沉淀,所以B中应该盛放饱和碳酸氢钠溶液,除去CO2中的氯化氢气体。
(2)C中反应的离子方程式为SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-。
(3)根据图②装置的特点可知,甲同学设计实验原理是强氧化剂生成弱氧化剂或活泼的非金属单质置换较不活泼的非金属单质。高锰酸钾溶液能把氯化氢氧化生成氯气,氯气能把碘化钾溶液氧化生成单质碘,反应的离子方程式是2I-+Cl2=2Cl-+I2。
点评:该题是高考中的常见题型,属于中等难度的试题。该题综合性强,侧重对学生实验能力的培养,提高学生的学科素养。有利于培养学生规范、严谨的实验设计、评价能力以及操作动手能力。该题需要明确的这种类型的试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。
本题难度:一般
5、实验题 (14分)某研究性学习小组的同学探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:

请回答:
(1)写出反应②的离子反应方程式__________________________________________。
(2)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是_____________________________________。
(3)乙同学在甲同学方案的基础上提出用滤渣B来制备 FeCl3?6H2O晶体,是将所得氯化铁溶液用加热浓缩、降温结晶法制得FeCl3?6H2O晶体,而不用直接蒸发结晶的方法来制得晶体的理由是__________________
(4)丙同学设计如下方案测定甲同学所制得的绿矾晶体中结晶水含量,其方法过程如下
①称取mg己研细的新制得的绿矾晶体,称量的方法是___________
a.直接将晶体放置于天平托盘上所垫的纸片上称量
b.将晶体置于干燥的坩埚中,然后再按a中操作进行称量
c.将晶体置于己准确称量的干燥坩埚中,然后再按a中操作进行称量
②在氮气流环境中加热坩埚中晶体使其失去全部结晶水后再停止加热,并仍在氮气流环境下冷却。放在氮气流中加热与冷却的原因是____________________________
③将坩埚放在天平上进行称量,称得质量为n1g
④重复②、③的操作,称得的质量为n2g,表明不需要再加热再称量的依据是________
⑤下表数据来是该同学实验报告中的数据,试求出晶体中X=_______
实验编号
| 坩埚质量
| 坩埚与晶体总质量
| 加热后坩埚与固体总质量
|
1
| 11.2g
| 25.1g
| 19.2g
|
2
| 11.2g
| 25.1g
| 18.8g
|
3
| 11.2g
| 25.1g
| 18.9g
参考答案:(1)AlO2- + CO2 + 2H2O= Al(OH)3↓+ HCO3-
(2)Cu + H2O2 + H2SO4 + 3H2O = CuSO4·5H2O或Cu+H2O2 + H2SO4 = CuSO4 + 2H2O
(3)因为氯化铁是强酸弱碱盐水解生成氢氧化铁和盐酸,加热蒸干时使HCl 挥发造成水解进行到底,因此得不到FeCl3?6H2O晶体
(4)①c?(2) ②防止加热中Fe2+被氧化;③n1-n2≤0.1g, ④7
本题解析:三种金属中只有铝能与碱反应生成NaAlO2、通过足量CO2后生成Al(OH)3溶液与NaHCO3。易知E是铜,铜与稀硫酸不反应,故Y有较强的氧化性,结合其为液体知为H2O2;D是FeSO4,可用NaOH 来检验Fe2+。FeCl3是挥发性酸的弱碱盐,直接加热盐溶液时能促使水解进行到底。
应先称量坩埚质量,再称坩埚与药品质量和;亚铁盐在温度较高的条件很易被空气氧化,故应放在氮气流中进行实验;当再次称量数据与第n1相差不超过0.1g时表明符合要求。因2、3两次称量结果相近而第一次与另外两次相差较大,故用2、3两次称量结果的平均值进行计算。
本题难度:一般
|