微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 2001年6月21日,河南的郑州、洛阳及南阳市率先使部分汽车采用封闭运行方式,试用新的汽车燃料——车用乙醇汽油。乙醇,俗名酒精,它是以玉米、小麦、薯类等为原料经发酵、蒸馏而制成的。乙醇进一步脱水,再加上适量汽油后形成变性燃料乙醇。而车用乙醇汽油就是把变性燃料乙醇和汽油按一定比例混配形成的车用燃料。结合有关知识,完成以下问题:
(1)乙醇的结构简式为_____________。汽油是由石油分馏所得的低沸点烷烃,其分子中的碳原子数一般在C5—C11范围内,如戊烷,其分子式为__________________,结构简式及其同分异构体分别为_____________、_____________、_____________。
(2)乙醇可由含淀粉〔(C6H10O5)n〕的农产品,如玉米、小麦、薯类等经发酵、蒸馏而得。请写出由淀粉制乙醇的化学方程式:
①淀粉+水 葡萄糖(C6H12O6)
葡萄糖(C6H12O6)
②葡萄糖 乙醇
乙醇
(3)淀粉可由绿色植物经光合作用等一系列生物化学反应得到,即水和二氧化碳经光合作用生成葡萄糖,由葡萄糖再生成淀粉。进行光合作用的场所是_____________,发生光合作用生成葡萄糖的化学方程式是
__________________________________________________________。
(4)乙醇充分燃烧的产物为__________________和__________________。
(5)车用乙醇汽油称为环保燃料,其原因是__________________________________________。
2、选择题 某碳酸钾样品中的杂质含有纯碱、硝酸钾、硝酸钡中的一种或两种。取7.8 g该样品溶于适量水中得到澄清溶液,再加入过量CaCl2溶液得到沉淀5.0 g。下列对原样品中所含杂质的判断正确的是(?)
A.一定没有Na2CO3和Ba(NO3)2
B.一定有Na2CO3而没有Ba(NO3)2
C.没有Ba(NO3)2但有KNO3,可能还有Na2CO3
D.没有Na2CO3但有Ba(NO3)2和KNO3
3、填空题 某工厂的废水中含有FeSO4、H2SO4、Ag2SO4、Al2(SO4)3及一些污泥。某研究性学习课题组测定了废水中各物质的含量并查找了溶解度数据,现列表如下
表一废水中各物质的含量
物质
| FeSO4
| H2SO4
| Ag2SO4
| Al2(SO4)2
| 污泥
|
质量分数/(%)
| 15.0
| 7.0
| 0.40
| 0.34
| 5.0
|
表二? FeSO4和Al2(SO4)3在水中的溶解度
温度/℃
| 0
| 10
| 20
| 30
| 40
| 50
|
FeSO4溶液度(g)
| 15.6
| 20.5
| 26.5
| 32.9
| 40.2
| 48.6
|
Al2(SO4)3溶解度(g)
| 31.2
| 33.5
| 36.4
| 40.4
| 45.7
| 52.2
|
?该课题组根据表中数据,设计了污水处理方案,拟利用该厂的废铁屑(有少量锈斑)、烧碱溶液和硫酸处理此污水,回收FeSO4·7H2O和Ag。
(1)请填写下列空白,完成得到Ag的实验方案:
①将带有锈斑的废铁屑先后用热的烧碱溶液和热水进行洗涤,目的是?。
②将工厂废水过滤,用少量水洗涤滤渣,洗涤液并入滤液后保留待用;
③?,目的是使Ag+全部还原为金属Ag;
④?,目的是分离出Ag;
(2)请写出后续的步骤,除去Al3+,得到主要成分为FeSO4·7H2O晶体。
⑤将第?步与第④步所得滤液混合后,加入少量硫酸至混合液的pH为3-4后,?,滤出FeSO4·7H2O晶体
(3)写出步骤③中所有化学反应的离子方程式?。
(4)在步骤⑤中,加入少量硫酸调节pH的目的是?。
4、实验题 (16分)某课外小组在实验室制备氨气,并进行有关氨气的性质探究。
(1)该小组同学加热生石灰与氯化铵的混合物制取干燥的氨气。
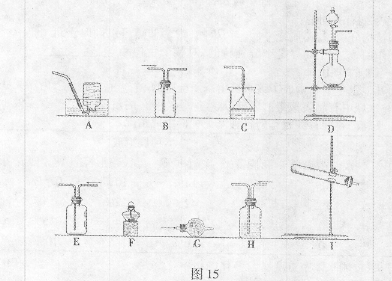
①应该选用的仪器及装置有(填字母)?。
②生石灰与氯化铵反应生成氨气的化学方程式为?。
(2)该小组同学设计如图16所示装置探究氨气的还原性。

①氨催化氧化的化学方程式为?。
②若实验时通入氨气的速率过快,在烧瓶中会出现白烟,该物质的化学式为?。
(3)该小组同学以氨气和二氧化碳为原料制备碳酸氢铵。
①甲同学先将二氧化碳通入水中,充分溶解后,再通入氨气;乙同学先将氨气通入水中,充分溶解后,再通入二氧化碳。再选择合适的方案并说明原因。
②检验产物中有NH4+的方法为?。
5、实验题 某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中观察到一些现象,并产生了相关的思考。
(1)向盛KI溶液的试管中滴加氯水,溶液呈棕黄色。如果继续向试管中滴加氯水,充分振荡,溶液逐渐变浅,最后变成无色。写出并配平溶液由棕黄色变成无色的化学反应方程式(如果系数是1,不用填写):

(2)将KI溶液换成KBr溶液,滴加氯水,溶液呈橙黄色;滴加氯水至过量,颜色没有变化。则Cl2、HIO3、HBrO3氧化性由强到弱的顺序是?。
(3)为证明溴单质的氧化性强于Fe3+,在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈棕黄色。为了证明棕黄色溶液是由于Fe3+的存在,而不是溴单质颜色所致,应当采取的补充实验是?
(4)在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有1/3的Br—被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为?