|
高考化学试题《铁的氧化物》高频考点预测(2017年最新版)(四)
2017-08-10 01:43:16
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在冶金工业上,均不能用通常化学还原剂制得的金属组是( )。
A.Na,Mg,Al
B.Na,K,Zn,Fe
C.Zn,Fe,Cu,Ag
D.Mg,Al,Zn,Fe
参考答案:A
本题解析:根据金属的活动性顺序有下列冶炼方法:①从K~Al,用电解法;②Zn~Cu用还原剂(如H2,CO等)还原法;③Hg和Ag用加热分解法2HgO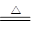 2Hg+O2↑。 2Hg+O2↑。
本题难度:简单
2、实验题 (10分)实验室可以用下图装置进行CO还原赤铁矿(主要成分为Fe2O3)并测定其中铁的含量的实验(假设杂质不参与反应)。请回答下列问题:
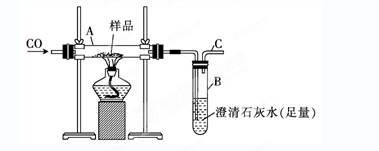
(1)该实验中炼铁的方法是________(填字母)。
A.热分解法
B.热还原法
C.电解法
D.湿法冶金
| (2)实验开始后,B中的现象是____________________,A中反应的化学方程式是________________________________________________________。
(3)写出铝和Fe2O3?反应的化学方程式?演示实验引发该反应的方法是?
(4)若样品的质量为3.6 g,通入足量的CO充分反应后,B增重2.64 g,则样品中铁的质量分数为_____?_? (结果保留一位小数)。
参考答案:(1)B? (2)有白色沉淀生成;Fe2O3+3CO2Fe+3CO2
(3) Fe2O3+2Al2Fe+Al2O3?在铝热剂上放KClO3,插上镁条并将镁条点燃?
(4)62.2%
本题解析:(1)CO具有还原性,答案选B。
(2)CO的氧化产物是CO2,CO2能和氢氧化钙溶液反应生成白色沉淀。CO还原氧化铁的方程式为Fe2O3+3CO2Fe+3CO2。
(3)铝也具有还原性,能发生铝热反应,方程式为 Fe2O3+2Al2Fe+Al2O3。
(4)B增重2.64 g,说明CO2是2.64g,物质的量是0.06mol。因此根据方程式可知生成铁是0.04mol,所以样品中铁的质量分数为0.04mol×56g/mol÷3.6g×100%=62.2%。
本题难度:一般
3、选择题 有Al、CuO、Fe2O3组成的混合物共10.0 g,放入500 mL某浓度的盐酸溶液中,混合物完全溶解,当再加入250 mL 2.0 mol/L的NaOH溶液时,得到的沉淀最多。上述盐酸溶液的浓度为( )
A.0.5 mol/L
B.3.0 mol/L
C.2.0 mol/L
D.1.0 mol/L
参考答案:D
本题解析:本题涉及的反应较多,若按各步反应进行计算则无从下手,可采用守恒法,由于得到沉淀最多时,溶液中的溶质只有NaCI,则n(HCI)=n(NaOH)=0.250×2.0=0.50moL,C(HCI)=1.0moL/L,D正确。
本题难度:一般
4、填空题 CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。
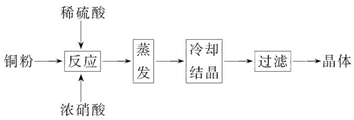
根据题意完成下列填空:
(1)向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象:_____________、_____________。
(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4·5H2O中可能存在的杂质是_____________,除去这种杂质的实验操作称为_____________。
(3)已知:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4。称取0.100 0 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.100 0 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用
0.100 0 mol/L盐酸滴定至终点,耗用盐酸20.16 mL,则0.100 0 g该试样中含CuSO4·5H2O_____________g。
(4)上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用_____________。
参考答案:(1)铜粉溶解,溶液呈蓝色?有红棕色气体产生
(2)Cu(NO3)2?重结晶? (3)0.098 0
(4)标准盐酸润洗2~3次
本题解析:(1)铜和浓硝酸反应的化学方程式为:Cu+4HNO3(浓)=Cu(NO3)2+
2NO2↑+2H2O,其反应现象是铜逐渐溶解,溶液变蓝,产生红棕色气体。加入稀硫酸的目的是H+和Cu(NO3)2中的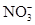 结合成HNO3,继续和铜反应,尽可能地降低溶液中 结合成HNO3,继续和铜反应,尽可能地降低溶液中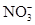 的含量,得到纯净的CuSO4。(2)CuSO4·5H2O中可能存在少量的Cu(NO3)2杂质,它和CuSO4一样都易溶于水,可以利用它们的溶解度随温度的变化程度不同,采用重结晶的方法分离提纯。(3)跟CuSO4反应的n(NaOH)=0.100 0 mol/L×(0.028 00 L-0.020 16 L)=7.84×10-4 mol,n(CuSO4)= 的含量,得到纯净的CuSO4。(2)CuSO4·5H2O中可能存在少量的Cu(NO3)2杂质,它和CuSO4一样都易溶于水,可以利用它们的溶解度随温度的变化程度不同,采用重结晶的方法分离提纯。(3)跟CuSO4反应的n(NaOH)=0.100 0 mol/L×(0.028 00 L-0.020 16 L)=7.84×10-4 mol,n(CuSO4)=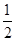 n(NaOH)=3.92× n(NaOH)=3.92×
10-4 mol,m(CuSO4·5H2O)=3.92×10-4 mol×250 g/mol=0.098 0 g。(4)滴定管在注入盐酸之前,先用蒸馏水洗净,再用标准盐酸润洗2~3次
本题难度:一般
5、选择题 在FeCl3、CuCl2和HCl的混合液中加入铁粉,待反应结束,所剩固体滤出后不能被磁铁吸引,则反应后溶液不可能大量存在的阳离子是
A.H+
B.Fe3+
C.Fe2+
D.Cu2+
参考答案:
本题解析:因铁的化学性质,可以与氯化铁和氯化铜反应:2FeCl3+Fe=3FeCl2,CuCl2+Fe=FeCl2+Cu,由于反应结束后所剩固体不能被磁铁吸引,即铁粉反应完全,所以反应后溶液不能大量存在Fe3+?
点评:本题主要考查了铁的化学性质,需要强调的铁可以与氯化铁发生反应.
本题难度:简单
|