微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列化学用语表达正确的是( ? )
A.羟基的电子式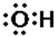
B.乙烯的结构简式是CH2CH2
C.醛基的结构简式是-COH
D.淀粉的分子式是?(C6H10O5)n
参考答案:D
本题解析:
本题难度:简单
2、选择题 物质的下列性质不能用键能来解释的是( )
A.氮气的化学性质没有氯气活泼
B.HF比HCl稳定
C.金刚石的熔点比晶体硅高
D.常温下溴呈液态,碘呈固态
参考答案:D
本题解析:氮气中混盐三键,键能大,性质稳定,A和键能有关系;分子的稳定性和共价键强弱有关系,B和键能有关;C中都是原子晶体,熔点和键能大小有关系;D中形成的是分子晶体,熔沸点和分子间作用力有关系,和键能无关,答案选D。
点评:键能是气态基态原子形成1mol化学键时释放的最低能量,属于键参数的范畴,分之间作用力不是化学键,不存在键能。
本题难度:一般
3、选择题 意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子,N4分子结构与白磷(P4)相同,如图所示,已知断裂1molN-N键吸收167KJ能量,生成1mol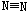 放出942KJ能量,根据以上信息和数据判断下列说法正确的是(?)
放出942KJ能量,根据以上信息和数据判断下列说法正确的是(?)
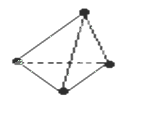
A.N4分子是一种新型化合物
B.N4和N2互为同素异形体
C.N4比N2稳定
D.1molN4转变为N2将吸收882KJ的能量
参考答案:B
本题解析:A、N4由N组成,是一种单质,而化合物是由不同元素组成的纯净物,故A错误;B、依据题意N4是分子,同位素研究的对象是原子,N4与N2互称为同素异形体,故B正确;C、根据键能分析,键能越大键越牢固,分子越稳定,所以N2化学性质比N4稳定,故C错误;D、1 mol N4气体转变为2molN2,1 mol N4气体断键吸收167×6=1002kJ,生成2molN2成键放出942×2=1884kJ,△H=1002-
1884="-882" kJ/mol,所以反应放热882 kJ热量,故D错误。
本题难度:一般
4、选择题 A和B是同周期的相邻元素,B和C是同主族的相邻元素,且A、B、C最外层电子数之和为19,则A、B、C三种元素按照顺序是( )
A.N、F、Cl
B.F、O、S
C.S、Cl、O
D.S、O、F
参考答案:A和B是同周期的相邻元素,B和C是同主族的相邻元素,且A、B、C最外层电子数之和为19,则在周期表中可能存在以下几种位置:
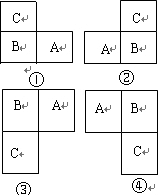
①设A的最外层电子数为x,则B、C的最外层电子数都为x-1,则有x+x-1+x-1=19,x=7,则A为Cl,B为S,C为O;
②设A的最外层电子数为x,则B、C的最外层电子数都为x+1,则有x+x+1+x+1=19,x=173,不符合题意;
③设A的最外层电子数为x,则B、C的最外层电子数都为x-1,则有x+x-1+x-1=19,x=7,则A为F,B为O,C为S;
④设A的最外层电子数为x,则B、C的最外层电子数都为x+1,则有x+x+1+x+1=19,x=173,不符合题意,
故选B.
本题解析:
本题难度:简单
5、填空题 .已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。E的硫酸盐溶液是制备波尔多液的原料之一。回答下列问题(用元素符号或化学式表示)。
(1)M分子中B原子轨道的杂化类型为?,1mol M中含有σ键的数目为?。
(2)化合物CA3的沸点比化合物BA4的高,其主要原因是?。
(3)写出与BD2互为等电子体的C3-的结构式?。
(4)E+的核外电子排布式为??,下图是E的某种氧化物的晶胞结构示意图,氧的配位数为??。
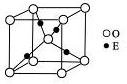
(5)向E的硫酸盐溶液中通入过量的CA3,写出该反应的离子方程式:?。
参考答案:(1)sp2? 3NA(或3×6.02×1023)?(2分)
(2)NH3分子间能形成氢键?(2分)?
(3)[N=N=N]-?(2分)?
(4)1s22s22p63s23p63d10? 4?(每空2分)
(5)Cu2++4NH3=[Cu(NH3) 4]2+?(2分)
本题解析:略
本题难度:一般