微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 CaCO3广泛存在于自然界,是一种重要的化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。
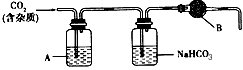
完成下列填空:
(1)用浓盐酸配制1:1(体积比)的稀盐酸(约6 mol·L-1),应选用的仪器是____。
a.烧杯
b.玻璃棒
c.量筒
d.容量瓶
(2)上述装置中,A是____溶液,NaHCO3溶液可以吸收____。
(3)上述装置中,B物质是____ 。用这个实验得到的气体测定CO2的分子量,如果B物质失效,测定结果____(填“偏高”、“偏低”或“不受影响”)。
(4)一次性饭盒中石蜡(高级烷烃)和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:剪碎、称重 浸泡溶解
浸泡溶解 过滤
过滤 残渣烘干
残渣烘干 冷却、称重
冷却、称重 恒重
恒重
为了将石蜡和碳酸钙溶出,应选用的试剂是____。
a.氯化钠溶液
b.稀醋酸
c.稀硫酸
d.正己烷
(5)在溶出量测定实验中,为了获得石蜡和碳酸钙的最大溶出量,应先溶出_______ ,后溶出______。
(6)上述测定实验中,连续______________ ,说明样品已经恒重。
参考答案:(1)abc
(2)CuSO4溶液或酸性KMnO4溶液;HCl气体或酸性气体
(3)无水CaCl2 ;偏低
(4)bd
(5)石蜡;CaCO3
(6)两次称量的结果相差不超过(或小于)0.001 g
本题解析:
本题难度:一般
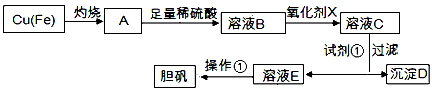
2、实验题 下图是利用废铜屑(含杂质铁)制备胆矾(硫酸铜晶体)的流程。
已知:
请回答:
(1)溶液B中含有的阳离子有________(填离子符号)。
(2)下列物质中最适宜做氧化剂X的是________(填字母)。
a.NaClO b.H2O2 c.KMnO4
(3)加入试剂①是为了调节pH,试剂①可以选择________(填化学式)。
(4)操作①的名称是________。
(5)沉淀D加入盐酸可以得到FeCl3,关于FeCl3溶液的性质中说法不正确的是________
a.将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
b.向FeCl3溶液滴加NaOH溶液,出现红褐色沉淀
c.将FeCl3溶液加热蒸干并灼烧,得到FeCl3固体
d.向FeCl3溶液中滴加KSCN溶液,溶液变为红色
(6) 沉淀D加入盐酸和铁粉,可以制得FeCl2溶液,实验室保存FeCl2溶液,需加入过量的铁粉,其原因是
________________(用离子方程式表示),还需要加入过量的盐酸,原因是________________。
参考答案:(1)Fe2+、Fe3+、 H+、Cu2+
(2)b
(3)CuO或CuCO3或Cu(OH)2
(4)蒸发结晶
(5)c
(6)2Fe3++Fe=3Fe2+;抑制Fe2+水解
本题解析:
本题难度:困难
3、实验题 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用下图所示的装置制取乙酸乙酯。回答下列问题

(1)写出制取乙酸乙酯的化学反应方程式_____________________________。
(2)浓硫酸的作用是:①_____________;②_____________。
(3)饱和碳酸钠溶液的主要作用是___________________________________。
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止_________。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是__________________________。
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)__________________。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
参考答案:(1)CH3COOH+C2H5OH CH3COOC2H5+H2O
CH3COOC2H5+H2O
(2)①催化剂;②吸水剂
(3)除去乙酸,吸收乙醇,降低乙酸乙酯的溶解度
(4)倒吸
(5)分液
(6)②④⑤
本题解析:
本题难度:困难
4、实验题 某学生拟用50mLNaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入过量CO2气体而生成
NaHCO3,他设计了如下实验步骤:
①取25mLNaOH溶液吸收过量的CO2气体,至CO2气体不再有
②小心煮费溶液1~2分钟排出溶液中溶解的CO2气体
③将得到的溶液中加入另一半(25mL)NaOH溶液,使溶液充分混合。

(1)能否制得较纯净的Na2CO3_________________理由是_________________
(2)按他的设计,第1步实验装置如图
①装置A中的离子反应方程式_________________
②装制B中的试剂是_________________作用是_________________
③有人认为实验步骤由②③的顺序对调,即先混合,再煮费,更合理,你认为对吗?_________________
(填合理或不合理),为什么?_________________。
参考答案:(1)能;等物质的量的NaHCO3和NaOH完全反应生成Na2CO3
(2)①CaCO3+2H+====CaCl2+CO2↑+H2O;②饱和NaHCO3溶液;除去HCl;③不合理;溶于水的CO2的会与NaOH作用生成一部分NaHCO3
本题解析:
本题难度:一般
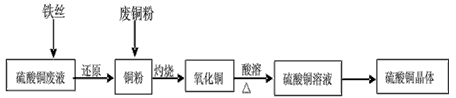
5、实验题 利用废铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废铜粉制备硫酸铜晶体。生产过程如下:
试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,可能发生反应的离子方程式有___________。
(2)废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物。原因是:
①灼烧不充分Cu未被完全氧化。
②CuO被还原。还原剂是_____,该还原反应的化学方程式是_____________________。
(3)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是(用化学反应方程式表示)______________。
(4)直接向氧化铜混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,但实际操作中较少使用,原因可能是____________。
参考答案:(1)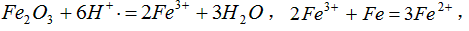
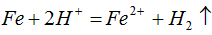
(2)C或CO;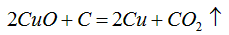
(3)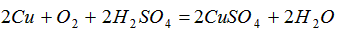
(4)生成等量硫酸铜晶体所消耗的硫酸更多,且会产生污染大气的气体SO2
本题解析:
本题难度:一般