微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 实验室利用废铜合金(含少量铁和铝)来制取硫酸铜晶体(CuSO4·xH2O),方案如下:
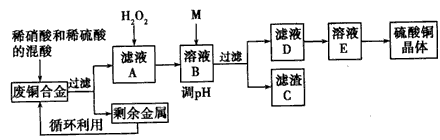
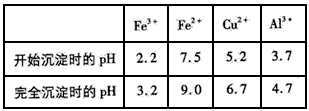
金属离子生成氢氧化物沉淀的pH可参考下列数据:
请回答:
(1)写出加入混酸后,合金中铜溶解的离平方程式__________ 。
(2)若溶解合金时加入的混酸由2 L3 mol/L硫酸和1L 2 mol/L硝酸混合而成,则反应后生成标准状况下的NO的体积最多为____________。
(3)加入H2O2的目的是____________。
(4)为保证产品的纯度,M物质最好选用___________ (填字母), 调节pH的范围为____。
a. Cu(OH)2
b. H2SO4
c. NH3·H2O
d. Na2CO3
(5)滤液D中加入硫酸的目的为____________ 。
(6)从溶液E制得CuSO4·xH2O晶体所需要的步骤为_______ 、_________、过滤、干燥。
(7)要测定所得硫酸铜晶体CuSO4·xH2O中x的值,下列说法不正确的是____(填字母)。
a.称量操作至少要进行4次
b.需将坩埚放在石棉网上进行加热
c. 加热后,将坩埚放在石棉网上冷却,会使所测x的值偏小
2、实验题 羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,其常用的制备方法有两种:方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中.方法B:剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中.?
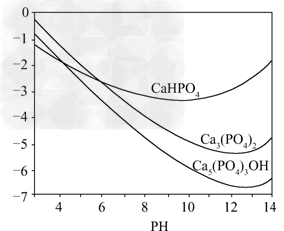
3种钙盐的溶解度随溶液pH的变化如上图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学反应方程式
①5Ca(NO3)2+3(NH4)2HPO4+4NH3·H2O=== Ca5(PO4)3OH↓+________+________.
②5Ca(OH)2+3H3PO4===________.
(2)与方法A相比,方法B的优点是________.
(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是________________________.
(4)图中所示3种钙盐在人体中最稳定的存在形式是________(填化学式).
(5)糖黏附在牙齿上,在酶的作用于下产生酸性物质,易造成龋齿,结合化学平衡移动原理,分析其原因____________________________________.
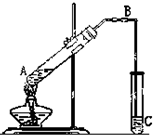
3、简答题 脂类化合物在日常生活中的应用越来越广泛.下图是实验制备乙酸乙酯的装置图,请填写下列空白
(1)试管A中加入无水冰醋酸,但加热后得不到乙酸乙酯,原因是______.(2)导管B的作用______.
(3)试管C中的试剂是______,玻璃导管不能插在液面下,原因是______
(4)要将乙酸乙酯从C中混和物中分离出来的方法是______,必须用到的玻璃仪器是______;
(5)试管A中发生反应的化学方程式为:______.
4、实验题 I.(1)下列有关实验操作或测量数据合理的是___________(填写序号)
a.用铁坩埚加热CuSO4·5H2O晶体测定结晶水质量分数
b.用干燥的pH试纸测定浓硫酸的pH
c.用规格为20mL的量筒,量取16.8 mL的Na2CO3溶液
d.实验室酸制氯化亚锡溶液时,可以先将氯化亚锡溶解在盐酸中,再配制到所需要的浓度
e.使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤干净
f.在用稀硫酸和锌粒反应制取氢气时加入少许硫酸铜以加快化学反应速率
II.实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫。有人设计如图所示实验以确认上述混合气体中有乙烯和二氧化硫。试回答下列问题。

(2)实验室制备乙烯的化学方程式______________________。升温到140℃时的副反应产物的结构简式
___________。
(3)图中①.②.③.④装置可盛放的试剂是:①___________;②___________;③___________;
④___________。(将下列有关试剂的序号填入空格内)
A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液
(4)能说明二氧化硫气体存在的现象是______________________
(5)使用装置②的目的是_________________________________
(6)使用装置③的目的是_________________________________
(7)确定含有乙烯的现象是_______________________________
5、实验题 “烂板液”是制印刷锌板时,用稀HNO3腐蚀锌板后得到的废液,主要含Zn(NO3)2和由自来水带进的Cl-、Fe3+等杂质离子。在实验室中由“烂板液”制取ZnSO4·7H2O的过程如下
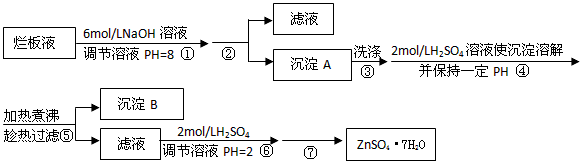
已知有关金属离子形成氢氧化物沉淀时的pH见下表

⑴第①反应是使Zn2+、Fe3+沉淀,检验Fe3+是否沉淀完全的操作是____________。
⑵第②步操作中需要的玻璃仪器有____________。
⑶第④步中PH应保持在____________范围内。
⑷第⑥步调节溶液PH=2的目的是____________。
⑸操作⑦包含3个基本实验操作,它们是蒸发浓缩、____________和过滤。