微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题
菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。
某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:

试回答下列问题:
(1)试剂1是?,试剂2是?,加入新制氯水后溶液中发生的离子反应方程式是?,?;
(2)加入试剂2后溶液中颜色由淡黄色转变为淡红色是因为?,写出
+2价Fe在空气中转化为+3价Fe的化学方程式?;
(3)该同学猜想血红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,
你认为该同学的猜想合理吗??。若你认为合理,请说明理由(若你认为不
合理,该空不要作答)?;若你认为不合理请提出你的猜想并设计一个简单的
实验加以验证(若你认为合理,该空不要作答)?。
参考答案:(14分)(1)稀盐酸? KSCN溶液? 2Fe2++C12=2Fe3++2C1-
Fe3++SCN-=[Fe(SCN)]2+? (前二空格各1分,后二空格各2分)
(2)少量的Fe2+转化为Fe3+,加入KSCN后显淡红色4FeCl2+4HCl+O2=4FeCl3+2H2O
(每空2分)
(3)不合理我的猜想是[Fe(sCN)]2+离子中的SCN-被过量的氯水氧化。设计的实验为在
褪色后溶液加入FeCl3溶液,仍不变红色(或在褪色后溶液加入加入KSCN溶液,变红色)
(第l空1分,第2空3分)
本题解析:根据题意,(1):检验时先将药品制成溶液,以便于检验,“速力菲”药品不溶于水但能溶于人体中的胃酸,所以试剂1选用稀盐酸即可;要检验亚铁离子,需要先检验有无三价铁离子,然后检验其被氧化后生成了三价铁离子即可,故试剂2选用KSCN溶液;(2)在加入试剂2后溶液中颜色由淡黄色转变为淡红色,说明还是有少量三价铁离子,原因是亚铁离子容易被氧化,在空气中酸性条件下可能生成少量三价铁离子,使溶液变淡红。(3)中三价铁离子不具备被还原的条件,因为溶液中加入的是过量氯水,三价铁离子一定存在,故只可能SCN-不存在,所以结合溶液成分只能是SCN-被过量氯水氧化,检验方法可得。
本题难度:一般
2、选择题 下列实验操作中,正确的是( )
A.用半透膜分离淀粉胶体和KI溶液
B.蒸馏操作时,应将温度计插入烧瓶中的溶液中
C.测溶液的pH时,将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较
D.分液操作时,先将分液漏斗中的下层液体从下口放出,然后再将上层液体也从下口放出
参考答案:A.胶体粒子直径在1nm~100nm之间,不能透过半透膜,但溶液溶质粒子可透过,所以可用半透膜分离淀粉胶体和KI溶液,故A正确;
B.蒸馏时,温度计的使用目的是测量馏分的温度,则温度计水银球因在蒸馏烧瓶的支管口附近,故B错误;
C.测溶液的pH时,不能将pH试纸放入溶液中,防止污染药品,应用玻璃棒蘸取溶液滴在pH试纸上,故C错误;
D.分液时,上层液体从上口倒出,下层液体从下口放出,防止重新污染,故D错误.
故选A.
本题解析:
本题难度:简单
3、填空题 某工厂排出的污水中含有大量的Fe2+、Zn2+、Hg2+三种金属离子。以下是某化学研究性学习小组的同学设计的除去污水中的金属离子,回收绿矾、皓矾(ZnSO4·7H2O)和汞的方案。
[药品] NaOH溶液、硫化钠溶液、硫化亚铁、稀硫酸、铁粉
[实验方案]
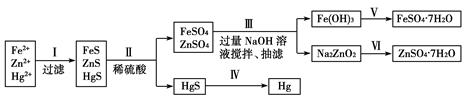
[问题探究]
(1)步骤Ⅱ所发生反应的离子方程式为_________________________________________________。
(2)步骤Ⅲ中的抽滤为减压条件下的过滤,可以加快过滤速度;该步骤涉及反应的离子方程式有Zn2++4OH-=ZnO22-+2H2O和________________。
(3)步骤Ⅵ中得到硫酸锌溶液的离子反应方程式为______________________________。
(4)欲实现步骤Ⅴ,所需加入的试剂有________、________,所涉及的主要操作依次为______________________。
(5)步骤Ⅳ常用的方法是加热,该步骤是否对环境有影响?__________(填“是”或“否”),如有影响,请你设计一个环境保护方案来实现步骤Ⅳ的反应________________________。
参考答案:(1)FeS+2H+=Fe2++H2S↑,ZnS+2H+=Zn2++H2S↑
(2)4Fe2++O2+8OH-+2H2O=4Fe(OH)3↓
(3)ZnO22-+4H+=Zn2++2H2O
(4)稀硫酸 铁粉 过滤、浓缩结晶、过滤
(5) 是 在密闭容器中加热HgS
本题解析:(1)步骤Ⅱ加入稀硫酸,与FeS、ZnS分别发生复分解反应,可写成离子方程式。
(2)FeSO4、ZnSO4混合溶液中加入过量的NaOH时,Fe2+与OH-反应生成Fe(OH)2,Fe(OH)2迅速被空气中的O2氧化为Fe(OH)3,其总反应的离子方程式为:4Fe2++O2+8OH-+2H2O=4Fe(OH)3↓。
(3)根据框图转化关系,可以看出Zn(OH)2的性质类似于Al(OH)3,所以Na2ZnO2溶液中加入过量的H2SO4生成ZnSO4溶液,其离子方程式为:ZnO22-+4H+=Zn2++2H2O。
(4)氢氧化铁能与稀硫酸反应生成硫酸铁,硫酸铁能与过量铁单质反应生成二价铁离子,然后过滤、浓缩结晶、过滤得到FeSO4?7H2O。
(5)HgS在空气中加热可得Hg、SO2,Hg蒸气和SO2都会对环境产生污染,但在密闭容器中加热HgS可有效防止Hg蒸气和SO2释放到大气中,从而保护了环境。
本题难度:一般
4、填空题 水体中重金属铅的污染方向问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如图所示:
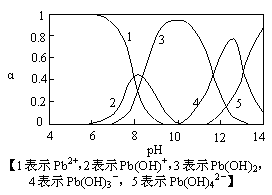
(1)Pb(NO3)2溶液中,c(NO3-)/c(Pb2+)__________ 2(填“>”、“=”、“<”=;往该溶液中滴入氯化铵溶液后,c(NO3-)/c(Pb2+)增加,可能的原因是___________ 。
(2)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有___________ ,pH=9时主要反应的离子方程式为____________ 。
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
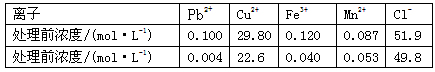
上表中除Pb2+外,该脱铅剂对其它离子的去除效果最好的是_____________ 。
(4)如果该脱铅剂(用EH)脱铅过程中主要发生的反应为:
2EH(s)+Pb2+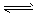 E2Pb(s)+2H+,则脱铅的最合适pH范围为 ____________(填代号)。
E2Pb(s)+2H+,则脱铅的最合适pH范围为 ____________(填代号)。
A 4~5
B 6~7
C 9~10
D 11~12
参考答案:(1)> ;Pb2+ +2Cl-=PbCl2↓降低了c(Pb2+)
(2)Pb2+、Pb(OH)+ ;Pb2++2OH-=Pb(OH)2↓
(3)Fe3+
(4)B
本题解析:
本题难度:一般
5、选择题 若从溴水中把溴萃取出来,可选用的萃取剂是
[? ]
A.水?
B.无水酒精?
C.四氯化碳?
D.氢氧化钠溶液?
参考答案:C
本题解析:
本题难度:简单