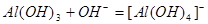微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)钨是我国丰产元素,也是熔点最高的金属,被誉为“光明使者”。用黑钨矿[FeWO4、MnWO4(W为+6价)]结合其它化工生产高纯钨的化工流程如下。已知H2WO4是不溶于水的弱酸,受热可分解生成氧化物。请回答下列有关问题:
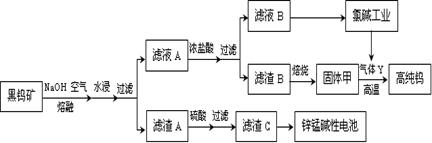
(1)上述流程中通入空气的目的是 ;
(2)滤渣A与硫酸反应的离子方程式为 ;
(3)实验室用锌锰碱性电池作做电源模拟氯碱工业的装置如下图:
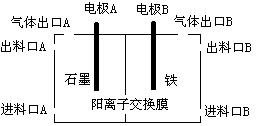
已知:锌锰碱性电池的总反应为Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH,则锌锰碱性电池的锌电极应与装置中电极 (填“A”或“B”)相接,气体Y为气体出口 (填“A”或“B”)出来的气体,为提高生产效率,电解开始时,从进料口B加入的物质为 ,写出锌锰碱性电池正极反应式 ;
(4)已知:单质碳也可与固体甲制得钨,用气体Y而不用单质碳的原因 ;
(5)将H2与CO2以4:1的体积比混合,在适当的条件下可制得CH4。已知:
CH4 (g) + 2O2(g)  CO2(g)+ 2H2O(1) ΔH1=-890.3 kJ/mol
CO2(g)+ 2H2O(1) ΔH1=-890.3 kJ/mol
H2(g) + 1/2O2(g)  H2O(1) ΔH2=-285.8 kJ/mol
H2O(1) ΔH2=-285.8 kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是 。
2、选择题 下列离子方程式表达不正确的是 ( )
A.小苏打溶液跟烧碱溶液反应:
B.氢氧化钡溶液跟硫酸反应:
C.三氯化铁溶液跟过量氨水反应: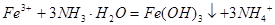
D.氢氧化铝与氢氧化钠溶液反应: