|
|
|
高中化学知识点讲解《离子方程式的书写及正误判断》高频试题特训(2017年最新版)(十)
2017-08-10 01:50:07
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)钨是我国丰产元素,也是熔点最高的金属,被誉为“光明使者”。用黑钨矿[FeWO4、MnWO4(W为+6价)]结合其它化工生产高纯钨的化工流程如下。已知H2WO4是不溶于水的弱酸,受热可分解生成氧化物。请回答下列有关问题:
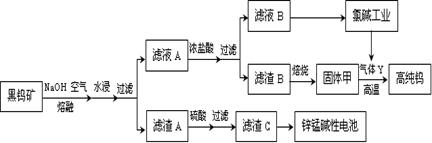
(1)上述流程中通入空气的目的是 ;
(2)滤渣A与硫酸反应的离子方程式为 ;
(3)实验室用锌锰碱性电池作做电源模拟氯碱工业的装置如下图:
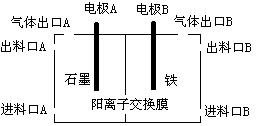
已知:锌锰碱性电池的总反应为Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH,则锌锰碱性电池的锌电极应与装置中电极 (填“A”或“B”)相接,气体Y为气体出口 (填“A”或“B”)出来的气体,为提高生产效率,电解开始时,从进料口B加入的物质为 ,写出锌锰碱性电池正极反应式 ;
(4)已知:单质碳也可与固体甲制得钨,用气体Y而不用单质碳的原因 ;
(5)将H2与CO2以4:1的体积比混合,在适当的条件下可制得CH4。已知:
CH4 (g) + 2O2(g)  CO2(g)+ 2H2O(1) ΔH1=-890.3 kJ/mol CO2(g)+ 2H2O(1) ΔH1=-890.3 kJ/mol
H2(g) + 1/2O2(g)  H2O(1) ΔH2=-285.8 kJ/mol H2O(1) ΔH2=-285.8 kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是 。
参考答案:(14分)
⑴ 氧化Fe2+、Mn2+(2分)
⑵ Fe2O3 + 6H+= 2Fe3+ + 3H2O 或 Fe3O4 + 8H+= 2Fe3++ Fe2++ 4H2O(2分)
⑶ B(1分) B(1分)
稀氢氧化钠溶液(1分) MnO2 + e-+ H2O =" MnOOH" + OH-(2分)
⑷会引入杂质碳;会生成碳化钨(2分,任答一点)
⑸CO2(g)+4H2(g)=CH4(g)+2H2O(l)ΔH=-252.9kJ/mol(3分)
本题解析:(1)因为锌锰碱性电池中含有二氧化锰,所以通入空气的目的是氧化Fe2+、Mn2+,使其转化为Fe3+、Mn4+;
(2)因为亚铁离子被氧化为铁离子,与氢氧化钠反应生成氢氧化铁沉淀,在加热条件下,最终转化为氧化铁或四氧化三铁,所以滤渣A与稀硫酸反应实质是氧化铁与稀硫酸反应,离子方程式是Fe2O3 + 6H+= 2Fe3+ + 3H2O 或 Fe3O4 + 8H+= 2Fe3++ Fe2++ 4H2O;
(3)碱性锌锰电池的Zn发生氧化反应,作原电池的负极,滤液A与盐酸反应生成钨酸沉淀,焙烧分解生成WO3,氯碱工业中产生的气体有氢气和氯气,而氢气可还原WO3为W,氢气在负极产生,而Fe不能做阳极,所以Fe极为阴极,所以锌锰碱性电池的锌电极应与装置中电极B相连,则氢气在B口出来的气体;为增强溶液的导电性,在进料口B处加入稀NaOH溶液;碱性锌锰电池的正极发生还原反应,二氧化锰得到电子生成MnOOH,电极反应式为MnO2 + e-+ H2O =" MnOOH" + OH-;
(4)若用碳单质还原WO3,则W中可能含有C单质,而用氢气还原,则不会产生杂质;
(5)利用盖斯定律将氧气消去,所以CO2(g)与H2(g)反应生成CH4(g)与液态水的反应热ΔH=4ΔH2-ΔH1=-252.9kJ/mol,所以CO2(g)与H2(g)反应生成CH4(g)与液态水的的热化学方程式是CO2(g)+4H2(g)=CH4(g)+2H2O(l)ΔH=-252.9kJ/mol。
考点:考查工业流程的分析,电化学反应原理的应用,盖斯定律的应用
本题难度:困难
2、选择题 下列离子方程式表达不正确的是 ( )
A.小苏打溶液跟烧碱溶液反应:
B.氢氧化钡溶液跟硫酸反应:
C.三氯化铁溶液跟过量氨水反应: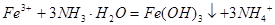
D.氢氧化铝与氢氧化钠溶液反应: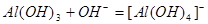
|
参考答案:B
本题解析: 漏掉了某些反应,硫酸钡的产生:
B. 氢氧化钡溶液跟硫酸反应:Ba2++SO42- +BaSO4↓ +BaSO4↓
本题难度:一般
3、选择题 下列离子方程式中,不正确的是
A.稀硫酸中加入氧化铜:
B.盐酸与澄清石灰水混合: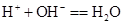
C.铁片插入稀硫酸中: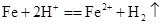
D.硫酸钠溶液和氯化钡溶液混合: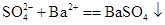
|
参考答案:A
本题解析:A.CuO不溶于水,应写成化学式,稀硫酸中加入氧化铜,反应的离子方程式为CuO+H+=Cu2++H2O,A错误;B.盐酸与石灰水混合,发生H++OH-=H2O,B正确;C.铁和硫酸反应生成硫酸亚铁和氢气,为Fe+2H+=Fe2++H2↑,C正确; D.硫酸钠溶液和氯化钡溶液混合:SO42-+Ba2+=BaSO4↓,D正确,选A。
考点:考查离子方程式的正误判断。
本题难度:一般
4、填空题 (6分)请分别选用一种试剂除去下列物质中的杂质,并写出相应的离子方程式。
| 物质
| 杂质
| 所选试剂
| 离子方程式
|
①
| NaCl溶液
| Na2CO3
|
|
|
②
| Mg粉
| Al粉
|
|
|
参考答案:①稀盐酸 CO32-+2H+=H2O+CO2↑ ②NaOH溶液 2Al+2OH-+2H2O=2AlO2-+3H2↑
本题解析:①碳酸钠与稀盐酸反应生成氯化钠,CO2和水,能除去NaCl溶液中的碳酸钠杂质,离子方程式为:CO32-+2H+=H2O+CO2↑ ②镁和NaOH溶液不反应,而铝反应,可以用氢氧化钠溶液除去镁粉中的铝粉,离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑。
考点:考查物质的除杂及离子方程式的书写等知识。
本题难度:一般
5、选择题 下列各组中两种物质在溶液中的反应,可用同一离子方程式表示的是
A.CuCl2+NaOH;CuSO4+NH3·H2O
B.KHCO3+HNO3;K2CO3+HNO3
C.NaHCO3+ H2SO4; Ba(HCO3)2+ H2SO4
D.Ba(OH)2+HCl;KOH+H2SO4
参考答案:D
本题解析:A项CuCl2+2NaOH的离子方程式为:Cu2++2OH-= Cu(OH)2↓,CuSO4+2NH3·H2O的离子方程式为:Cu2++2NH3·H2O= Cu(OH)2↓+2NH4+,A错误;KHCO3+HNO3的离子方程式为:HCO3-+ H+= H2O+ CO2↑K2CO3+2HNO3的离子方程式为:CO32- +2 H+= H2O+ CO2↑B错误;NaHCO3+ H2SO4的离子方程式为:HCO3-+ H+= H2O+ CO2↑, Ba(HCO3)2+ H2SO4的离子方程式为:2HCO3-+ 2H++ Ba2++SO42-= 2H2O+2CO2↑+Ba SO4, C错误;Ba(OH)2+HCl的离子方程式为:H+ + OH-= H2O,KOH+H2SO4的离子方程式为:H+ + OH-= H2O,D正确。
考点:离子方程式的书写
本题难度:一般