微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 氮化硅( Si3N4)是一种优良的高温结构陶瓷,在工业生产和科技领域有重要用途.
I.工业上有多种方法来制备氮化硅,常见的方法有:
方法一:直接氮化法:在1300℃-1400℃时,高纯粉状硅与纯氮气化合,其反应方程式为
?。
方法二:化学气相沉积法:在高温条件下利用四氯化硅气体、纯氮气、氢气反应生成氮化硅和HC1,与方法一相比,用此法制得的氮化硅纯度较高,其原因是?.
方法三:Si(NH2)4热分解法:先用四氯化硅与氨气反应生成Si(NH2)4和一种气体(填分子式)________;然后使Si(NH2)4受热分解,分解后的另一种产物的分子式为?。
II.工业上制取高纯硅和四氯化硅的生产流程如下:
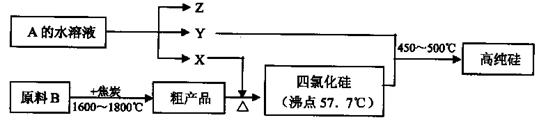
已知:X、高纯硅、原料B的主要成分都可与Z反应,Y与X在光照或点燃条件下可反应,Z的焰色呈黄色.
(1)原料B的主要成分是(写名称)?。
(2)写出焦炭与原料B中的主要成分反应的化学方程式:?。
(3)上述生产流程中电解A的水溶液时,阳极材料能否用Cu?(填“能”或“不能”),写出Cu为阳极电解A的水溶液开始一段时间阴阳极的电极方程式:
阳极:?;阴极:?。
参考答案:I:3Si + 2N2 Si3N4;方法一所得产品中混有硅或方法二除产品是固体外其它物质均为气体;HCl(1分),NH3(1分)
Si3N4;方法一所得产品中混有硅或方法二除产品是固体外其它物质均为气体;HCl(1分),NH3(1分)
Ⅱ:(1)二氧化硅?
(2)SiO2 + 2C Si + 2CO↑
Si + 2CO↑
(3)不能(1分),阳Cu -2e- =Cu2+?阴2H+ +2e-=H2↑(除标注外,其余各2分)
本题解析:I.硅与纯氮气发生化合反应,制得Si3N4,但所得产品中混有硅,不容易分离,方法二中除Si3N4外,其余都为气体,产品纯度高;方法三根据质量守恒定律,可以推断气体成分。II.Y与X在光照或点燃条件下可反应,可推断为H2和Cl2,X、高纯硅、原料B的主要成分都可与Z反应,Z的焰色呈黄色.可推断Z是NaOH,X是Cl2,Y是H2, B是SiO2,A是NaCl,电解是若用Cu做阳极,铜的还原性强,失电子发生氧化反应,阴极H+得电子发生还原反应。
本题难度:困难
2、选择题 地球上的大部分水为海水,若能找到海水淡化的大规模生产方法,将可极大地缓解目前人类面临的水资源日益短缺的状况。下列有关海水淡化的方法在原理上可行的是(?)
A.加明矾使海水中的盐分沉淀而淡化
B.在一定条件下将海水缓慢过滤以获得淡水
C.利用太阳能将海水蒸发淡化
D.在一定条件下选择CCl4作萃取试剂,将海水萃取而淡化
参考答案:C
本题解析:A、海水中含有大量的钙镁离子等,加入明矾不能使钙镁离子除去,反而引入铝离子,错误;B、过滤只能除去不溶于水的固体物质,不能使海水淡化,错误;C、海水中盐的沸点较高于水的沸点,利用太阳能将海水蒸发,可以使水与盐类分离,达到淡化的目的,同时还具有环保的作用,正确;D、海水中钙镁离子、氯离子等不溶于CCl4,所以选择CCl4作萃取试剂,不能萃取其中的钙镁离子等,错误,答案选C。
本题难度:简单
3、填空题 玻璃钢可由酚醛树脂和玻璃纤维制成。
(1)酚醛树脂有苯酚和甲醛缩聚而成,反应有大量热放出,为防止温度过高,应向已有苯酚的反应釜中___________加入甲醛,且反应釜应装有_____________装置。
(2)玻璃纤维由玻璃拉丝得到。普通玻璃是由石英砂、______和石灰石(或长石)高温熔融而成,主要反应的化学方程式为_____________________、_____________________。
(3)玻璃钢中玻璃纤维的作用是__________。玻璃钢具有___________等优异性能(写出亮点即可)。
(4)下列处理废旧热固性酚醛塑料的做法合理的是_________。
a.深埋 b.粉碎后用作树脂填料 c.用作燃料 d.用有机溶剂将其溶解,回收树脂
参考答案:(1)间歇性;散热
(2)纯碱;Na2CO3+SiO2 Na2SiO3+CO2;CaCO3+SiO2
Na2SiO3+CO2;CaCO3+SiO2 CaSiO3+CO2
CaSiO3+CO2
(3)增强体;强度高、质量轻、耐腐蚀、抗冲击、绝缘性能好
(4)bc
本题解析:
本题难度:一般
4、选择题 下列物品所用材料为硅酸盐的是( )
A.水晶镜片
B.陶瓷餐具
C.石英光导纤维
D.计算机芯片
参考答案:B
本题解析:
本题难度:简单
5、填空题 (12分)CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
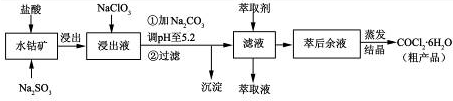
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物
| Fe(OH)3
| Fe(OH)2
| Co(OH)2
| Al(OH)3
| Mn(OH)2
|
开始沉淀
| 2.7
| 7.6
| 7.6
| 4.0
| 7.7
|
完全沉淀
| 3.7
| 9.6
| 9.2
| 5.2
| 9.8
|
(1)写出浸出过程中Co2O3发生反应的离子方程式?。
(2)NaClO3的作用是?。
(3)加Na2CO3调pH至5.2所得沉淀为?。
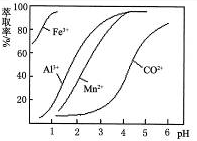
(4)萃取剂对金属离子的萃取率与pH的关系如图。萃取剂的作用是?;其使用的适宜pH范围是?。
A.2.0~2.5? B.3.0~3.5? C.4.0~4.5
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是?。(答一条即可)
参考答案:(12分)
(1)Co2O3+SO32-+4H+=2Co2++SO42-+2H2O?(2分)
(2)将Fe2+氧化成Fe3+?(2分)
(3)Fe(OH)3? Al(OH)3?(2分)
(4)除去溶液中的Mn2+?B?(每空2分)
(5)粗产品含有可溶性氯化物或晶体失去了部分结晶水?(2分)
本题解析:略
本题难度:一般