微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 工业上制造普通玻璃的主要原料是______________,主要设备是______________,主要原料熔化后,发生的主要化学反应是___________________________________________、________________________________。普遍玻璃的成分是____________________________。
参考答案:纯碱、石英、石灰石;玻璃熔炉;SiO2+Na2CO3 Na2SiO3+CO2↑;SiO2+CaCO3
Na2SiO3+CO2↑;SiO2+CaCO3 CaSiO3+CO2↑;
CaSiO3+CO2↑;
Na2SiO3、CaSiO3、SiO2
本题解析:
本题难度:一般
2、选择题 现在人类直接利用主要的化石能源是
A.太阳能
B.核能
C.氢能
D.煤
参考答案:D
本题解析:考查化学与生活及生产等。答案选D。
本题难度:简单
3、选择题 下列金属的冶炼适宜用电解法来冶炼的是
A.铁
B.铜
C.钠
D.铅
参考答案:C
本题解析:电解法一般用来冶炼比较活泼的金属,例如钠和铝等,故本题的答案选择C,由Fe、Zn、Cu、Pb等中等活泼金属用热还原法,即以C、CO或H2做还原剂还原冶炼。
点评:本题考查了金属的冶炼,属于对化学基本知识的考查,本题还要掌握:由于Hg、Ag等不活泼金属的氧化物不稳定,受热易分解,一般采用热分解法冶炼;V、Cr、Mn、W等高熔点金属一般用铝热反应产生的高温来冶炼。本题难度适中。
本题难度:一般
4、填空题 (12分)高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
湿法:强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液
干法:Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
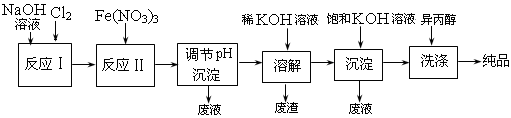
①反应I的化学方程式为 ? 。
②反应II的离子方程式为 ? 。
③加入饱和KOH溶液的目的是 ? 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为 ? ;? ______?____。
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为 。
参考答案:(1)①2NaOH + Cl2=NaCl + NaClO + H2O
②3ClO-+ 10OH-+ 2Fe3+=2FeO42-+ 3Cl-+ 5H2O
③增大K+ 浓度,促进K2FeO4晶体析出
(2)高铁酸钾有强氧化性,能杀菌消毒,产生的Fe(OH)3胶体有吸附性,可将杂质一起凝聚而沉降?(3)3∶1
本题解析:(1)①氯气溶解在氢氧化钠溶液中,生成氯化钠和次氯酸钠,反应式为2NaOH + Cl2=NaCl + NaClO + H2O。
②次氯酸钠具有氧化性,能把硝酸铁氧化生成高铁酸盐,而次氯酸钠被还原生成氯化钠,反应式为3ClO-+ 10OH-+ 2Fe3+=2FeO42-+ 3Cl-+ 5H2O。
③加入饱和氢氧化钾溶液,能增大钾离子浓度,促使K2FeO4晶体析出。
(2)高铁酸钾具有强氧化性,能杀菌消毒,还原产物是铁离子。而铁离子能水解生成氢氧化铁胶体,吸附溶液中的杂质形成沉淀而析出。
(3)1mol氯气在反应中只能得到1mol电子,生成次氯酸钠。而1mol硝酸铁能失去3mol电子,所以氧化剂和还原剂的物质的量之比是3︰1。
本题难度:一般
5、填空题 (12分)工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
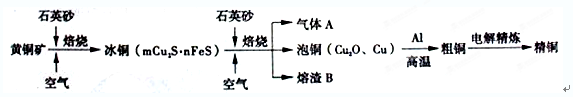
⑴气体A中的大气污染物可选用下列试剂中的____________吸收。
a.浓H2SO4? b.稀HNO3?c.NaOH溶液? d.氨水
⑵用稀H2SO4 浸泡熔渣B,取少量所得溶液,检验溶液中还存在Fe3+的方法是_______________________(注明试剂、现象)。
⑶由泡铜冶炼粗铜的化学反应方程式为__________________________________。
⑷以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是____________。
a.阴阳极的质量变化相等? b.电解质溶液的组成不发生变化
c.溶液中Cu2+向阳极移动? d.利用阳极泥可回收Ag、Pt、Au等金属
⑸利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为________________________________________。
参考答案:⑴cd?⑵滴加KSCN溶液,若溶液变为血红色则存在Fe3+。
⑶3Cu2O+2Al Al2O3+6Cu?⑷d?⑸O2+4e-+4H+=2H2O
Al2O3+6Cu?⑷d?⑸O2+4e-+4H+=2H2O
本题解析:(1)根据流程图可知,A应该是SO2。由于SO2是酸性氧化物,所以吸收SO2可选择cd。稀硝酸能氧化SO2,但还原产物是NO,仍然会污染环境,答案选cd。
(2)检验铁离子的常用试剂是KSCN溶液,即滴加KSCN溶液,若溶液变为血红色则存在Fe3+。
(3)铝是活泼的金属,能发生铝热反应,方程式是3Cu2O+2Al Al2O3+6Cu。
Al2O3+6Cu。
(4)由于粗铜中含有杂质,所以根据金属性强弱可知,阳极最初失去电子的是铝和锌。而阴极是始终是铜离子放电,所以ab不正确;电解池中阳离子向阴极移动,c不正确。铜的金属性强于Ag、Pt、Au,所以这些金属不会失去电子,最终形成阳极泥,答案选d。
(5)原电池中负极失去电子,正极得到电子,所以根据方程式可知,氧气在正极得到电子,反应式是O2+4e-+4H+=2H2O。
本题难度:一般