微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 常温下将0.010molCH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液,判断:
(1)溶液中有两种微粒的物质的量之和一定等于0.010mol,它们是__________和__________;
(2)溶液中n(CH3COO-) + n(OH-) - n(H+) = _____________mol。
2、填空题 Ⅰ.如图为向25mL0.1mol?L-NaOH溶液中逐滴加入0.2mol?L-醋酸溶液过程中溶液pH的变化曲线,请回答:
(1)有人认为B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?______(填“是”或“否”).若不正确,则二者恰好完全反应的点是在AB区间还是在BD区间内?______区间.(若正确,此问不答)
(2)在AB区间内,c(OH-)>c(H-),则c(OH-)与c(CH3COO-)的大小关系是______.
A.c(OH-)一定大于c(CH3COO-)?B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-)?D.c(OH-)可能大于、小于或等于c(CH3COO-)
(3)在D点时,溶液中c(CH3COO-)+c(CH3COOH)______2c(Na+).(填“大于”,“小于”或“等于”)
Ⅱ.已知硫酸钡的Ksp为1.0×10-10,碳酸钡的Ksp为2.58×10-9,工业上却可以将硫酸钡转化为碳酸钡,请问至少需要______?mol?L-的碳酸钠溶液浸泡才能实现转化.实现此转化的离子方程式为______.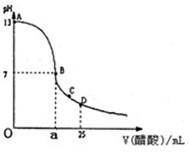
3、填空题 已知在25℃时,0.1mol/L醋酸溶液的pH约为3,向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:
甲同学认为醋酸钠水解溶液呈碱性,增大了c(OH-),因而溶液的pH增大。
乙同学认为醋酸钠溶于水电离出大量的醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
(1)上述两种解释中______________(填“甲”或“乙”)正确。
(2)为了验证上述哪种解释正确,继续做如下实验:向0.1mol/L醋酸溶液中加入少量下列物质中的______________(填写编号),然后测定溶液的pH。
A.固体CH3COOK
B.固体CH3COONH4
C.气体NH3
D.固体NaHCO3
(3)若_____________(填“甲”或“乙”)的解释正确,溶液的pH应____________(填“增大”、“减小”或“不变”)(已知25℃时,CH3COONH4溶液呈中性)。
(4)常温下将0.010molCH3COONa和0.004molHCl溶于水,配置成0.5L混合溶液,判断:
①溶液中共有____________种粒子;
②溶液中有两种粒子的物质的量之和一定等于0.010mol,它们是______________和___________;
③溶液中n(CH3COO-)+n(OH-)-n(H+)=____mol。
4、选择题 下列溶液中,微粒的物质的量浓度关系正确的是
[? ]
A.1.0mol·L-1的Na2CO3溶液:c(OH-)= c(HCO3-) +c(H+)+2c(H2CO3)
B.1.0mol·L-1的NH4Cl溶液:c(NH4+)= c(Cl-)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+) > c(CH3COO-)> c(H+)> c(OH-)
D.向硝酸钠溶液中滴加稀盐酸,得到pH=1的混合溶液:c(Na+) = c(NO3-)
5、选择题 下列说法正确的是( )
A.在KI溶液中加入氯化银,一段时间后沉淀变成黄色,说明同温度下K(AgI)<K(AgCl)
B.0.1mol?L-1的NaHCO3溶液:c(H+)+c(H2CO3)=2c(CO2-3)+c(OH-)
C.中和pH与体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比是1:1
D.NaHCO3溶液与NaAlO2溶液混合产生白色沉淀,说明酸性:HCO3-<Al(OH)3