微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 能源是人类生存和发展的重要支柱。研究和有效地开发新能源在能源紧缺的今天具有重要的理论意义。
(1)已知下列热化学方程式:
① H2(g)+1/2O2(g) =H2O(g)?ΔH=-241.8 kJ/mol?
② C(s)+1/2O2(g) =CO(g)?ΔH=-110.5 kJ/moL?
则水煤气能源的制取原理:C(s)+H2O(g)=H2(g)+CO (g)?ΔH=?kJ/moL
(2)研究活化能对于能源技术的革新有非常重大的实际意义。请认真观察下图,回答问题:
① 图中反应的ΔH=?kJ/mol(用含有E1、E2代数式表示)。
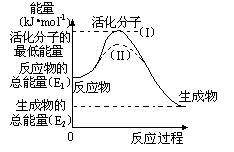
② 已知热化学 方程式:H2(g)+1/2O2(g) =?H2O(g)?ΔH=-
方程式:H2(g)+1/2O2(g) =?H2O(g)?ΔH=- 241.8 kJ/mol,该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为?kJ/mol。
241.8 kJ/mol,该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为?kJ/mol。
③ 图中虚线(II)与实线(I) 对于同一反应具有的意义:
??。
参考答案:(1)+131.3
(2)① —(E1- E2)或(E2-E1)
② 409?
③ 降低反应所需的活化能,增大单位体积内活化分子的百分 数,提高反应
数,提高反应 速率。
速率。
本题解析:略
本题难度:简单
2、选择题 由下图分析,下列说法正确的是

A.A=B+C与B+C=A两个反应吸收和放出的热量不等
B.A=B+C是放热反应
C.A具有的能量高于B和C具有的能量总和
D.A=B+C是吸热反应,B+C=A必然是放热反应
参考答案:D
本题解析:根据图像可知,B和C的总能量高于A的总能量,则A=B+C是吸热反应,其逆反应一定是放热反应,且热量值是相等的,ABC错误,D正确,答案选D。
点评:该题是高考中的常见题型,属于基础性试题的考查,难度不大。该题的关键是明确反应热的含义以及判断依据,并能结合图像灵活运用即可。
本题难度:简单
3、选择题 下列关于能量的说法错误的是
A.化学反应必然伴随发生能量变化
B.化学变化中的能量变化主要是由化学键变化引起的
C.反应条件是加热或高温的反应一定是吸热反应
D.反应物的总能量高于生成物的总能量时,反应放热
参考答案:C
本题解析:略
本题难度:简单
4、选择题 下列与化学反应能量变化相关的叙述正确的是( )
A.生成物能量一定低于反应物总能量
B.放热反应不必加热就一定能发生
C.应用盖斯定律,可计算某些难以直接测量的反应的焓变
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的ΔH不同
参考答案:C
本题解析:生成物能量高于反应物该能量,为吸热反应,反之为放热反应,A错误;吸、放热反应与反应条件无关,B错误;某些对应以直接测量的反应的反应热,可应用盖斯定律求解,C正确;化学反应的反应热ΔH与反应条件无关,取决于反应物与生成物的总能量的相对大小,D错误。
本题难度:一般
5、简答题 Ⅰ.指出下列变化能量是怎样转化的:
(1)学校燃烧煤煮饭______,(2)给手机的电池充电______,
(3)用蓄电池点亮灯泡______,(4)电解水得到O2和H2______.
Ⅱ.已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5
氢气体积(mL)
30
120
280
350
370
|
(1)①反应速率最大的(即0~1、l~2、2~3、3~4、4~5min)时间段为______.原因是______
②反应速率最小的时间段为______,原因是______
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入下列物质以减慢反应速率
A.蒸馏水?B.少量CuCl2晶体?C.NaCl溶液
你认为他的做法可行的是加入______?(填相应字母);其中他的做法中也有不可行的,其不可行的理由是______.
参考答案:I.(1)烧煤煮饭是煤燃烧发生化学反应放出能量,即化学能转化为热能.
(2)给手机充电是把对手机电池中物质进行电解,使电池的物质在阴极和阳极发生化学反应,即电能转化为化学能.
(3)蓄电池给灯泡供电,是蓄电池中的物质在正极和负极上得失电子产生电流,使灯泡发亮,即化学能转化为电能.
(4)电解水得到O2和H2,是氢离子和氢氧根离子分别在阴极得电子和在阳极失电子,发生了化学反应,即电能转化为化学能.
故答案为:化学能变热能;电能变化学能;化学能变电能;电能变化学能;
II.(1)①0~1、l~2、2~3、3~4、4~5min时间段内产生的氢气体积分别为:30mL、90mL、160mL、70mL、20mL,则2~3min时间内反应速率最大,其原因是,锌与稀硫酸反应为放热反应,随反应的进行,放出的热量使溶液温度升高,而升高温度会加快反应速率,即由于反应放热,溶液温度升高,反应速率加快.故答案为:2~3?min;由于反应放热,溶液温度升高,反应速率加快;
②根据①的计算可以看出,4~5?min时间段内放出的气体体积最少,反应速率最小,其原因是,随反应的进行,尽管溶液温度较高,但硫酸的难度会逐渐减小,而减小浓度,会使反应速率减小,即硫酸浓度降低,导致反应速率减慢.故答案为:4~5?min;硫酸浓度降低,导致反应速率减慢;
(2)为了减慢反应速率,可以降低反应温度、减低反应物的浓度,加入蒸馏水可以扩大硫酸溶液的体积而降低其浓度,加入NaCl溶液时,NaCl不参与反应,但会稀释硫酸,降低硫酸的浓度.因此能降低反应速率的有AC;当加入少量CuCl2晶体时,CuCl2会与锌反应置换出铜,锌、铜与硫酸会形成原电池,发生原电池反应而加快反应速率,即反应速率加快的原因是:Zn与CuCl2反应,析出的铜覆在Zn的表面形成原电池,加快了化学反应.故答案为:AC;Zn与CuCl2反应,析出的铜覆在Zn的表面形成原电池,加快了化学反应.
本题解析:
本题难度:一般