微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如下图所示,图I是恒压密闭容器,图II是恒容密闭容器。当其它条件相同时,在I、II中分别加入2?mol?X和2?mol?Y,开始时容器的体积均为VL,发生如下反应并达到平衡状态:
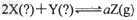 ,此时I中X、Y、Z的物质的量之比为1:3:2。下列判断正确的是
,此时I中X、Y、Z的物质的量之比为1:3:2。下列判断正确的是
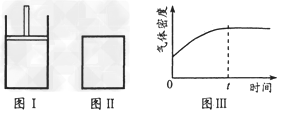
[? ]
A.?物质Z的化学计量数a=2
B.?若II中气体的密度如图III所示,则X、Y均为气态
C.?若X、Y均为气态,则在平衡时X的转化率:I?>II
D.?若X为固态、Y为气态,则I、II中从开始到平衡所需的时间:I〉II
参考答案:C
本题解析:
本题难度:一般
2、简答题 在真空密闭容器内加入a mol PH4I固体,在一定温度下发生如下反应:
PH4I(s)?PH3(g)+HI(g)
4PH3(g)?P4(g)+6H2(g)
2HI(g)?H2(g)+I2(g)
以上三反应建立平衡后,测得HI为b mol、I2(g)为c mol、H2为d mol.
(1)平衡后,容器内P4(g)和PH3的物质的量(用代数式表示):n(P4)=______;n(PH3)=______.
(2)a、b、c三者服从a>______(填b、c的代数式);b、c、d三者的关系服从b>______(填c、d的代数式).
(3)平衡后,增大压强,容器内n(I2)______,n(PH4I)______(填增大、减小、不变).
参考答案:建立平衡后,测得HI为bmol、I2(g)为cmol、H2为dmol,根据化学反应,则
PH4I(s)?PH3(g)+HI(g)
b+2cb+2cb+2c
4PH3(g)?P4(g)+6H2(g)
2(d-c)3 d-c6d-c
2HI(g)?H2(g)+I2(g)
2c c c
(1)平衡后,容器内P4(g)的物质的量是d-c6mol,PH3的物质的量是(b+2c)mol-2(d-c)3mol=(8c3+b-2d3)mol,
故答案为:d-c6;(8c3+b-2d3);
(2)在真空密闭容器内加入amol PH4I固体,由于反应是可逆的,所以a>b+2c;8c3+b-2d3>0,即b>2d3-8c3,
故答案为:a>b+2c;b>2d3-8c3;
(3)平衡后,增大压强,平衡PH4I(s)?PH3(g)+HI(g)逆向移动,平衡4PH3(g)?P4(g)+6H2(g)逆向移动,平衡2HI(g)?H2(g)+I2(g)不移动,所以结果是容器内n(I2)减小,n(PH4I)增大,
故答案为:减小;增大.
本题解析:
本题难度:简单
3、选择题 COCl2(g)?CO(g)+Cl2(g),△H>0.当反应达到平衡时,下列措施:①升温?②恒压通入惰性气体③增加CO的浓度?④减压?⑤加催化剂,能提高COCl2转化率的是( )
A.①④⑤
B.①②④
C.②③⑤
D.③④⑤
参考答案:化学反应COCl2(g)?CO(g)+Cl2(g)△H>0;是气体体积增大的反应,正向反应是吸热反应;
①升温平衡向吸热反应方向移动;平衡正向进行,COCl2转化率增大,故①符合;
②恒压通入惰性气体,压强增大,为保持恒压,体积增大压强减小,平衡正向进行;COCl2转化率增大,故②符合;
③增加CO的浓度,平衡逆向进行;COCl2转化率减小,故③不符合;
④减压平衡向气体体积增大的方向进行,平衡正向进行;COCl2转化率增大,故④符合;
⑤加催化剂,改变速率不改变平衡;COCl2转化率不变,故⑤不符合;
综上所述:①②④正确,
故选B.
本题解析:
本题难度:简单
4、填空题 (1)对于下列反应:2SO2?+?O2 2SO3,?如果2min内SO2的浓度由6?mol/L下降为2?mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。
2SO3,?如果2min内SO2的浓度由6?mol/L下降为2?mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。
(2)下图表示在密闭容器中反应:2SO2+O2 2SO3?△H<0?
2SO3?△H<0?
达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。

①ab过程中改变的条件可能是____________________;
②bc过程中改变的条件可能是____________________;?
③若加入催化剂,请将反应速度变化情况画在c~d处。
(3)请用化学平衡移动知识解释久置的氯水(尤其是长期放置在见光环境),最后浅黄绿色消失,溶液变成稀盐酸_________________。?
参考答案:(1)2mol/(L min);?1mol/(L
min);?1mol/(L min)?
min)?
(2)①升温;②减小?SO3浓度 ③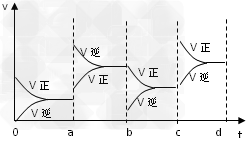 (3)在氯水中存在平衡:Cl2+H2O
(3)在氯水中存在平衡:Cl2+H2O HCl?+?HClO,HClO见光易分解为HCl和O2,使得平衡体系中HClO浓度减小,平衡向正反应方向移动,Cl2浓度减小、HCl浓度增大、最后浅绿色消失,溶液变成稀盐酸。
HCl?+?HClO,HClO见光易分解为HCl和O2,使得平衡体系中HClO浓度减小,平衡向正反应方向移动,Cl2浓度减小、HCl浓度增大、最后浅绿色消失,溶液变成稀盐酸。
本题解析:
本题难度:一般
5、选择题 增大压强,对已达到平衡的下列反应产生的影响是( )?
3P(g)+Q(g)?2R(g)+2S(s)
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
C.正、逆反应速率都增大,平衡向正反应方向移动
D.正、逆反应速率都没有变化,平衡不发生移动
参考答案:增大压强,反应气态混合物的浓度增大,正逆反应速率都增大,反应前后气体的气体减小,平衡向正反应移动,故A、B、D错误,C正确.
故选C.
本题解析:
本题难度:一般