微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
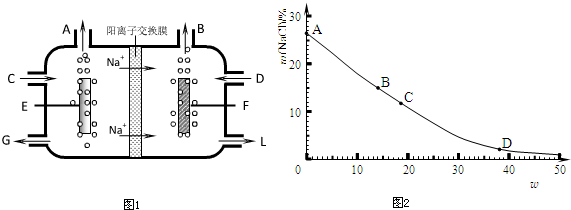
1、简答题 食盐不仅是生活必需品,也是生产氯气和烧碱的重要原料.下图1是工业电解饱和食盐水的离子交换膜电解槽示意图.
(1)B处出口产生的物质是______;C处进口的物质是______.
(2)______离子被阳离子交换膜阻止进入阳极区,原因是______.
(3)如图2所示,20℃时在混合溶液中,随着氢氧化钠含量的变化,氯化钠达到饱和状态时其溶质质量分数的变化曲线.
已知曲线上A、B、C、D四个点的坐标分别为:A(0,26.5);B(14.0,15.0);C(18.8,11.7);D(38.0,2.0).
①20℃时,氯化钠在水中的溶解度为______g.
②D点处氢氧化钠的物质的量浓度约为多大?(已知D点处溶液的密度约为1.4g?mL-1,计算结果保留两位有效数字)______
③若现有20℃时,满足曲线上B点指标的溶液,可用______方法尽可能地降低氯化钠的含量,达到提纯氢氧化钠的目的.
参考答案:(1)工业电解饱和食盐水,依据图装置分析,钠离子移向F极,说明F为阴极,E电极为阳极析出的是氯气,F电极析出的是氢气;故答案为:氢气;饱和食盐水;
(2)F电极生成氢气破坏了水的电离生成氢氧根离子,阳离子交换膜阻止氢氧根离子进入阳极区失电子生成氧气,混入氯气中;
故答案为:氢氧根;?避免氧气生成;
(3)①由曲线上A(0,26.5)点坐标可得,20℃时氯化钠在水中的饱和溶液的溶质质量为26.5%,此时氯化钠的溶解度为:
20℃氯化钠在水中溶解度=26.5100-26.5×100g≈36.1g;
故答:36.1;
②曲线上D(38.0,2.0)点表示:混合溶液中氢氧化钠含量为38.0%时,混合溶液中氯化钠达饱和状态其溶质质量分数为2.0%.换言之,若此时溶液质量为100g,其中含38.0g氢氧化钠时溶解氯化钠2.0g达到饱和.混合溶液中氢氧化钠含量为38.0%时的物质的量浓度c=1000cm3/L×1.4g/cm3×38.0%40g/mol=13mol/L;
故答案为:13;
③使B点的溶液尽可能地降低氯化钠的含量,根据曲线含义,只要使氢氧化钠的含量增大氯化钠的溶解能力就减小,氯化钠结晶析出,剩余溶液则为较纯净的氢氧化钠溶液.可采取蒸发水分浓缩溶液增大氢氧化钠的含量,结晶出氯化钠.
故答案:蒸发结晶.
本题解析:
本题难度:一般
2、选择题 某同学按图所示的装置进行电解实验,下列说法错误的是(? )。
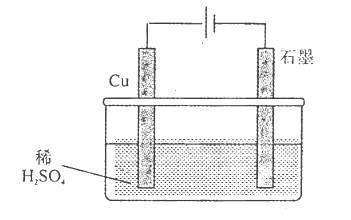
A.电解初期,石墨电极上有H2产生
B.整个电解过程中,H+的浓度不断增大
C.电解一定时间后,石墨电极上有铜析出
D.电解初期,总反应方程式为:
参考答案:B
本题解析:A、石墨作阴极,所以石墨极上H+放电成为氢气,正确;B、电解过程中H+不断放电成为氢气,所以H+的浓度不断减小,错误;C、铜作阳极失电子进入溶液,铜离子的氧化性> H+的氧化性,所以一定时间后铜离子先H+放电成为铜析出,正确;D、电解初期,铜失电子,H+得电子,反应方程式为

本题难度:简单
3、选择题 某同学按右图所示的装置进行电解实验。下列说法正确的是
 ?
?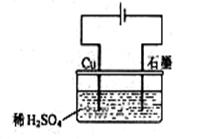
A.电解过程中,铜电极上有H2产生
B.电解初期,主反应方程式为:Cu+H2SO4 CuSO4+H2↑
CuSO4+H2↑
C.电解开始时,石墨电极上有铜析出
D.整个电解过程中,H+的浓度不断增大
参考答案:B
本题解析:电解池的电极反应分别为:
阳极:Cu-2e-=Cu2+
电解初期,溶液中主要是氢离子放电:2H++2e-=H2↑;(而当溶液中铜离子浓度较大时,铜离子才开始放电:Cu2++2e-=Cu)
所以总电解方程式为:Cu+H2SO4 ?CuSO4+H2↑,很容易看出B描述正确。
?CuSO4+H2↑,很容易看出B描述正确。
本题难度:一般
4、选择题 用惰性电极进行电解,下列说法正确的是( )
A.电解稀硫酸,实质上是电解水,故溶液pH不变
B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
参考答案:D
本题解析:电解稀硫酸实质上是电解水,c(H+)增大,溶液pH减小,A项错误;电解稀氢氧化钠溶液,实质上也是电解水,c(OH-)增大,溶液pH增大,B项错误;电解硫酸钠溶液,在阴极上生成H2,阳极上生成O2,其物质的量之比为2∶1,C项错误。D项正确。
本题难度:一般
5、选择题 串联电路中四个电解池分别装有0.5 mol·L-1的下列溶液,用惰性电极电解,连接直流电源一段时间后,溶液pH最小的是( )
A.KNO3溶液
B.NaCl溶液
C.AgNO3溶液
D.CuCl2溶液