微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某研究性学习小组根据反应2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。

回答下列问题:
(1)此原电池的正极是石墨 (填“a”或“b”),发生 反应。
(2)电池工作时,盐桥中的SO42-移向 (填“甲”或“乙”)烧杯。
(3)两烧杯中的电极反应式分别为:甲 ,乙 。
(4)若不考虑溶液的体积变化,MnSO4浓度变为1.5 mol·L-1,则反应中转移的电子为 mol。
参考答案:(1)a 还原 (2)乙
(3)MnO4-+5e-+8H+=Mn2++4H2O 5Fe2+-5e-=5Fe3+
(4)0.5
本题解析:(1)根据题目提供的总反应方程式可知,KMnO4作氧化剂,发生还原反应,故石墨a是正极。(2)电池工作时,SO42-向负极移动,即向乙烧杯移动。(3)甲烧杯中的电极反应式为MnO4-+5e-+8H+=Mn2++4H2O;乙烧杯中的电极反应式为5Fe2+-5e-=5Fe3+。(4)溶液中的MnSO4浓度由1 mol·L-1变为1.5 mol ·L-1,由于溶液的体积未变,则反应过程中生成的MnSO4的物质的量为0.5 mol·L-1×0.2 L=0.1 mol,转移的电子为0.1 mol×5=0.5 mol。
本题难度:一般
2、选择题 下列关于铜电极的叙述,正确的是()
A.黄铜(铜锌)制作的铜锣不易产生铜绿
B.用电解法精炼粗铜时,粗铜作阴极
C.在镀件上电镀铜时可用金属铜作阳极
D.电解稀硫酸制氢气、氧气时铜作阳极
参考答案:AC
本题解析:略
本题难度:简单
3、填空题 请观察下图装置,回答下列问题:?
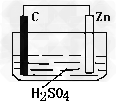
(1)?负极是________,发生_______反应(填氧化或还原) ?
(2)?正极是________,发生_______反应(填氧化或还原) ?
(3)?正极的电极反应式:__________________________?。
参考答案:(1)Zn,氧化
(2)C,还原
(3)2H+ + 2e- = H2↑
本题解析:
本题难度:一般
4、选择题 X、Y、Z和M代表四种金属元素。金属X和Z用导线连接放入稀硫酸中时,Z极上有H2放出;若电解Y2+和Z2+共存的溶液时,Y先析出;又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为( )
A.X>Z>Y>M
B.X>Y>Z>M
C.M>Z>X>Y
D.X>Z>M>Y
参考答案:D
本题解析:根据题意知,金属X和Z用导线连接放入稀硫酸中时,Z极上有氢气放出,则X是负极,Z是正极,金属的活动性X>Z;若电解Y2+和Z2+离子共存的溶液时,Y先析出,说明Y2+氧化性强于Z2+,金属的活动性Z>Y;M2+离子的氧化性强于Y2+离子,金属的活动性Y>M;综上所述,四种金属的活动性由强到弱的顺序为X>Z>Y>M,选D。
本题难度:一般
5、填空题 (1)现有如下两个反应:
A.NaOH + HCl =" NaCl" + H2O B.2FeCl3 + Cu = 2FeCl2 + CuCl2
①根据两反应本质判断, 能设计成原电池(填“A”或“B”)。
②如果(A或B)不能,说明其原因
(2)如图所示装置,烧杯中盛有滴有酚酞的NaCl饱和溶液,C(1)、C(2)为多孔石墨电极。
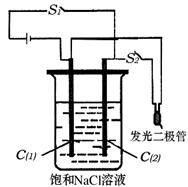
①接通S1后,两极均有气体生成,C(1)附近溶液显 色。装置内发生的总反应化学方程式为 。
②若有11.7g NaCl发生反应,理论上生成Cl2的体积(标准状况)为 。
③反应一段时间后(电极未脱离液面),断开S1,接通S2,观察到二极管发光。此时:C(2)的电极反应式是 。
参考答案:(1)B A为非氧化还原反应
(2)红 2NaCl+2H2O = 2NaCl+Cl2↑+ H2↑ 2.24L Cl2+2e—=2Cl—
本题解析:(1)原电池是电子在线路中定向移动,所以原电池反应必须是氧化还原反应
(2)①接通S1后,此装置为电解饱和氯化钠的装置:2NaCl+2H2O = 2NaCl+Cl2↑+ H2↑
负极所对应电极为阴极C(1):2H++2e-=H2↑
+
本题难度:一般