|
高考化学必考知识点《化学平衡的移动和应用》考点预测(2017年强化版)(八)
2017-08-10 02:08:31
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定温度下,向体积为2L的恒容密闭容器中充入1mol?PCl5(g),发生反应:
PCl5(g)?PCl3(g)+Cl2(g)△H=+Q?KJ/mol维持容器温度不变,测得容器内压强随反应时间的变化如图所示.下列说法正确的是( )
A.3s内的平均速率为:V(PCl3)=0.1mol?L-1?min-1
B.达到平衡时放出0.6QKJ热量
C.其他条件不变,再向容器中充入1molPCl5(g),则达新平衡时,C(PCl5)>0.4mol?L-1
D.其他条件不变,增大PCl5的浓度,平衡常数减小
| 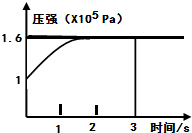
参考答案:A.恒温、恒容的密闭容器中,气体的物质的量之比等于压强之比,则平衡时混合气体的物质的量为1.6mol,气体的物质的量增大(1.6-1)mol=0.6mol,设生成PCl3的物质的量为x,
PCl5(g)?PCl3(g)+Cl2(g) 气体增加的物质的量
? 1mol? 1mol
?x? 0.6mol
x=1×0.61mol=0.6mol,
V(PCl3)=△nV△t=0.6mol2L3s=0.1mol/(L.s),时间单位是S不是min,故A错误;
B.该反应是吸热反应不是放热反应,当气体增加1mol时吸收的热量是QKJ,则气体增加0.6mol时吸收的热量是0.6QKJ,故B错误;
C.平衡体系中再加入1mol的PCl5,重新到达平衡状态,可以等效为开始加入2mol的PCl5,体积增大为原来的2倍,达平衡(该平衡与原平衡等效)后再将体积压缩到原来大小,与原平衡相比,压强增大,平衡向逆反应方向移动,则平衡浓度大于原来的两倍,故C正确;
D.温度不变,平衡常数不变,故D错误;
故选C.
本题解析:
本题难度:一般
2、简答题 化学反应原理在生产、生活、国防上有重要的应用.例如:
联氨(N2H4)及其衍生物是一类重要的火箭燃料.N2H4与N2O4反应能放出大量的热.
①已知:2NO2(g)?N2O4(g)△H=-57.20kJ?mol-1.
一定温度下,在密闭容器中反应2NO2(g)?N2O4(g)达到平衡.
其他条件不变时,下列措施能提高NO2转化率的是______(填字母).
A.减小NO2的浓度B.降低温度C.增加NO2的浓度D.升高温度
②下表为反应2NO2(g)?N2O4(g)在17℃、1.01×105Pa下的部分实验数据:
| 时间/s | 0 | 80 | 160 | 240 | 320
c(NO2)/mol?L-1
0.0540
0.0420
0.0340
0.0300
0.0300
c(N2O4)/mol?L-1
0
0.0060
0.0100
0.0120
0.0120
|
该温度下反应N2O4(g)?2NO2(g)的平衡常数K的值为______.
(写出计算过程)
③25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量.
则该反应的热化学方程式为______.
参考答案:①该反应是反应前后气体体积减小的、放热的可逆反应,要使该反应向正反应方向移动,可改变反应物的浓度、体系的压强、温度等.
A、减小N02的浓度,平衡向逆反应方向移动,N02的转化率降低,故A错误;
B.降低温度,平衡向正反应方向移动,N02的转化率提高,故B正确;
C.增加N02的浓度,平衡向正反应方向移动,且体系压强增大,也利于反应向正反应方向移动,故C正确;
D.升高温度,平衡向逆反应方向移动,N02的转化率降低,故D错误;
故答案为:BC;
②图表数据分析240s反应达到平衡状态,2NO2(g)?N2O4(g),平衡状态c(NO2)=0.0300mol?L-1,c(N2O4)=0.0120mol?L-1
K=c(N2O4)c2(NO2)=0.0120mol/L(0.0300mol/L)2=403;
该温度下反应N2O4(g)?2NO2(g)的平衡常数的值为K的倒数=340,
故答案为:340;
③1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量,则2molN2H4(l)的质量为2mol×32g/mol=64g,放出热量为19.14kJ×64=1224.96KJ的热量,标注物质聚集状态和对应反应的焓变写出反应的热化学方程式为:2N2H4(l)+N2O4(l)═3N2(g)+4H2O(l)△H=-1224.96KJ/mol,
故答案为:2N2H4(l)+N2O4(l)═3N2(g)+4H2O(l)△H=-1224.96KJ/mol.
本题解析:
本题难度:一般
3、选择题 2M(g) N(g);△H=-24.4 kJ/mol。现将M和N的混合气体通入体积为1L的恒温密闭容器中,反应体系中物质浓度随时间的变化关系如图所示。 N(g);△H=-24.4 kJ/mol。现将M和N的混合气体通入体积为1L的恒温密闭容器中,反应体系中物质浓度随时间的变化关系如图所示。
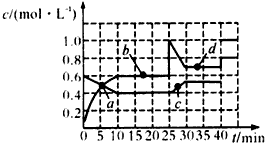
下列说法正确的是
[? ]
①a、b、c、d 四个点中处于平衡状态的点是a、b
②反应进行到25 min时,曲线发生变化的原因是加入了0.4mol N
③若调节温度使35 min时体系内N的体积分数与15 min时相等,应升高温度
④反应进行到10 min时,体系吸收的热量为4.88 kJ
⑤若40 min后出现如图所示变化,则可能是加入了某种催化剂
A.①③
B.②④
C.③④
D.③⑤
参考答案:C
本题解析:
本题难度:一般
4、选择题 A(g)+3B(g)?2C(g)△H<0达到平衡,改变下列条件,正反应速率始终增大,直达到新平衡的是( )
A.升温
B.加压
C.增大c(A)
D.降低c(C)
参考答案:A.该反应是放热反应,升高温度,平衡向逆反应方向移动,所以正反应速率始终增大,直达到新平衡,故A符合;
B.增大压强,平衡向正反应方向移动,则正反应速率先增大后减小,只达到新平衡,故B不符合;
C.增大A的浓度,平衡向正反应方向移动,则正反应速率先增大后减小,只达到新平衡,故C不符合;
D.降低C的浓度,平衡向正反应方向移动,则正反应速率始终减小,只达到新平衡,故D不符合;
故选A.
本题解析:
本题难度:一般
5、选择题 如图是恒温下某反应的反应速率随时间变化的示意图,下列叙述与示意图不相符合的是

[? ]
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡态I后,增大反应物浓度,平衡发生移动,达到平衡态II
C.该反应达到平衡态I后,减小反应物浓度,平衡发生移动,达到平衡态II
D.同一种反应物在平衡态I和平衡态II时浓度不相等
参考答案:C
本题解析:
本题难度:一般
| 