|
高中化学知识点讲解《常见的化学电源》考点特训(2017年冲刺版)(八)
2017-08-10 02:09:16
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 固体氧化物燃料电池( SOFC)以固体氧化物作为电解质,O2-可以 在其内部自由通过。其工作原理如图所示:下列关于固体燃料电池的有关说法正确的是
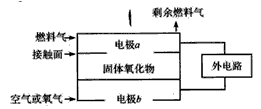
[? ]
A.电极b为电池负极,电极反应式为O2+4e-==4O2-
B.固体氧化物的作用是让电子在电池内通过
C.若H2作为燃料气,则接触面上发生的反应为H2+2OH--4e- ==2H2O
D.若C2H4作为燃料气,则接触面上发生的反应为C2H4+6O2--12e-==2CO2+2H2O
参考答案:D
本题解析:
本题难度:一般
2、选择题 科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。电池负极反应为:
A.H2+2OH-=2H2O+2e-
B.O2+4H++4e-=2H2O
C.H2 -2e-=2H+
D.O2+2H2O+4e-=4OH-
|
参考答案:C
本题解析:
A、电解质溶液呈酸性,负极上无OH-离子参与反应,故A不合题意;
B、负极发生氧化反应,氢气失去电子,该反应为正极反应,故B不合题意;
C、电解质溶液呈酸性,则负极上氢气失电子生成氢离子,电极反应为H2=2H++2e-,故C符合题意;
D、负极发生氧化反应,氢气失去电子,该反应为碱性溶液中正极反应,故D不合题意。
考点:考查燃料电池
点评:本题考查氢氧燃料电池及其工作原理,难度不大。在学习中应注意记忆其负正极的电极反应。
本题难度:一般
3、填空题 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液(滴有几滴酚酞)电解实验,如图所示。
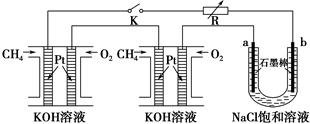
回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为________________________ 、________________________。
(2)闭合K开关后,a、b电极上均有气体产生,其中a电极上得到的是________;电解过程中________极(填“a”或“b”)附近会出现红色。电解氯化钠溶液的总化学方程式为________________________。将a、b两极的产物相互反应可得到“84”消毒液的有效成分NaClO,特殊情况下可用“84”消毒液吸收SO2,反应的离子方程式为________________________。
(3)若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上最多能产生的氯气体积为________L(标准状况)。
参考答案:(1)O2+2H2O+4e-=4OH-?CH4+10OH--8e-=CO32-+7H2O
(2)Cl2 b 2NaCl+2H2O 2NaOH+H2↑+Cl2↑ ClO-+SO2+H2O=Cl-+SO42-+2H+ 2NaOH+H2↑+Cl2↑ ClO-+SO2+H2O=Cl-+SO42-+2H+
(3)4
本题解析:(3)根据CH4+10OH--8e-=CO32-+7H2O、2Cl--2e-=Cl2↑和电子守恒知,计算关系式为CH4~8e-~4Cl2,所以标准状况下氯气体积为4 L。
本题难度:一般
4、填空题 请仔细观察两种电池的构造示意图,回答下列问题:

(1)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,则负极的电极反应式:
?
(2)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析
其原因是?
(3)某工厂回收废旧锌锰电池,其工艺流程如下:

已知:生成氢氧化物的pH如下表:
物质
| Fe(OH)3
| Fe(OH)2
| Zn(OH)2
| Mn(OH)2
| 开始沉淀pH
| 2.7
| 7.6
| 5.7
| 8.3
| 完全沉淀pH
| 3.7
| 9.6
| 8.0
| 9.8
|
?
①经测定,“锰粉”中除含少量铁盐和亚铁盐外,主要成分应是MnO2、Zn(OH)2?。
②第一次加入H2O2后,调节pH=8.0。目的
是?。
③试列举滤液4的应用实
例?。
参考答案:1)Zn+2OH--2e-=Zn(OH) 2(2分)。
(2)碱性锌锰电池用锌粉替代了原锌锰电池的锌壳,增大了反应物的接触面积,加快了反应速率,故放电电流大
(3)①MnOOH、C粉(2分)
②除去Zn(OH) 2和Fe(OH)3(1分)
③制备皓矾、回收金属锌等
本题解析:(1)电池负极应为Zn反应;(2)从影响化学反应速率的因素考虑
本题难度:一般
5、填空题 一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3+ + Cu ==2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e- ==Cu2+,还原反应式:2Fe3+ + 2e- ="=" 2Fe2+。并由此实现了化学能与电能的相互转化。据此,回答下列问题:
(1)将反应Zn + 2H+ = Zn2+ + H2↑拆写为两个“半反应式”:其中,氧化反应为:?。
(2)由题(1)反应,设计成原电池如图所示:
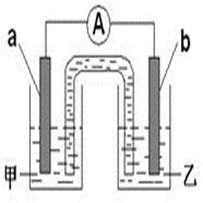
若电极a为Zn ,电极b可选择材料:?(只填一种);电解质溶液甲是?;电极b处的电极反应式:?。
(3)由反应2H2 + O2 2H2O ,设计出以稀硫酸为电解质溶液的燃料电池,其电极反应式为:负极??,正极?。 2H2O ,设计出以稀硫酸为电解质溶液的燃料电池,其电极反应式为:负极??,正极?。
参考答案:(1)Zn-2e-= Zn2+(2分)
(2)Cu(合理给1分),ZnSO4(1分),2H+ + 2e- = H2↑(2分).
(3)负极:2H2 - 4e- = 4H+ ,正极:O2 + 4H+ + 4e- = 2H2O(4分)
本题解析:(1)依据题意,由2Fe3+ + Cu ==2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e- ==Cu2+,还原反应式:2Fe3+ + 2e-==2Fe2+ ,可得:反应Zn + 2H+ = Zn2+ + H2↑拆写为两个“半反应式”,氧化反应为Zn失去2e-生成Zn2+,故氧化反应式为:Zn-2e-= Zn2+;
(2)如图,组成的原电池中若电极a为Zn ,则电解质溶液应为ZnSO4 ,电极b选择材料的化学性质应比锌不活泼,可为Cu或C,则电解质溶液已为稀H2SO4,故电极b处的电极反应式为:2H+ + 2e- = H2↑
(3)根据反应2H2 + O2 2H2O ,以稀硫酸为电解质溶液设计的燃料电池,其中负极的电极反应式为:2H2 - 4e- = 4H+ ,正极的电极反应式为:O2 + 4H+ + 4e- = 2H2O; 2H2O ,以稀硫酸为电解质溶液设计的燃料电池,其中负极的电极反应式为:2H2 - 4e- = 4H+ ,正极的电极反应式为:O2 + 4H+ + 4e- = 2H2O;
点评:该题是中等难度的试题,也是高考中的常见考点。试题注重基础,侧重能力的训练。该题的关键是明确原电池的工作原理,然后结合同样灵活运用、分析、判断即可。
本题难度:一般
|