微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 市场上出售的“热敷袋”的主要成分是铁屑、炭粉、木屑、少量氯化钠和水等。“热敷袋”启用之前用塑料袋使其与空气隔绝,启用时,打开塑料袋轻轻揉搓就会放出热量,使用完后,会发现有大量铁锈存在。
(1)热敷袋是利用________放出热量。
(2)炭粉的主要作用是__________________________________。
(3)加入氯化钠的主要作用是____________________________。
(4)木屑的作用是______________________________________。
(5)有关的电极反应式和化学方程式是____________________________________________。
参考答案:(1)铁被氧化
(2)与铁屑、NaCl溶液构成原电池,加速铁屑的氧化
(3)NaCl溶于水,形成电解质溶液
(4)使用“热敷袋”时受热均匀
(5)负极:Fe-2e-=Fe2+,正极:O2+2H2O+4e-=4OH-,Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3
本题解析:由铁丝能在氧气中燃烧同时迅速放出大量的热,可推知铁在潮湿的情况下生锈时也会放出热量,只是比燃烧缓慢一些。
日常生活中铁生锈过于缓慢,热量的释放也非常缓慢,难以觉察到。倘若提供适当的条件(如较浓的电解质溶液、导电且不活泼的固体物质)让铁成为原电池的负极材料,铁的氧化速率就会大大加快。木屑的作用是让“热敷袋”产生的热量均匀地向外散失、传递。铁屑、炭粉及NaCl溶液构成原电池,铁作负极,炭粉作正极,将化学能转化为电能,放出热量。
本题难度:一般
2、填空题 新型锂离子电池材料Li2 MSiO4(M为Fe,Co,Mn,Cu等)是一种发展潜力很大的电池电极材料。工业制备Li2 MSiO4有两种方法:
方法一:固相法,2Li2SiO3+ FeSO4 Li2FeSiO4 +Li2SO4 +SiO2
Li2FeSiO4 +Li2SO4 +SiO2
方法二:溶胶—凝胶法,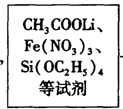
 Li2FeSiO4
Li2FeSiO4
(1)固相法中制备Li2 FeSiO4过程采用惰性气体气氛,其原因是 ;
(2)溶胶—凝胶法中,检查溶液中有胶体生成的方法是 ;生产中生成Imol Li2FeSiO4整个过程转移电子物质的量为 mol;
(3)以Li2 FeSiO4和嵌有Li的石墨为电极材料,含锂的导电固体作电解质,构成电池的总反应式为:Li+ LiFeSiO4 Li2FeSiO4则该电池的负极是____ ;充电时,阳极反应的电极反应式为 ;
Li2FeSiO4则该电池的负极是____ ;充电时,阳极反应的电极反应式为 ;
(4)使用(3)组装的电池必须先____ 。
参考答案:(11分)(1)防止Fe2+被氧化成Fe3+ (2分) ;
(2)用一束强光照射溶液,从侧面能观察到一条光亮的通路。(2分);1mol (2分)
(3)嵌有Li的石墨(2分) Li2FeSiO4-e-=LiFeSiO4+Li+(2分) (4)充电(1分)
本题解析:(1)Fe2+具有还原性,故采用惰性气体气氛的原因是防止Fe2+被氧化成Fe3+。
(2)检查有无胶体生成,利用胶体的特征现象,即用一束强光照射溶液,从侧面能观察到一条光亮的通路。
(3)电池的负极失去电子、化合价升高,故负极是嵌有Li的石墨。阳极失去电子,化合价升高,电极式为Li2FeSiO4-e-=LiFeSiO4+Li+。
(4)使用(3)组装的电池必须先充电。
考点:锂电池的制备原理 信息题
点评:本题考查的是锂电池的制备原理的信息题,题目难度大,利用好题中信息是解题的关键。
本题难度:困难
3、选择题 X,Y,Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y为电池的负极。X,Y,Z 3种金属的活动性顺序为
[? ]
A.X>Y>Z
B.X>Z>Y
C.Y>X>Z
D.Y>Z>X
参考答案:C
本题解析:
本题难度:一般
4、简答题 课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y?都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
(1)电源A?极的名称是______.
(2)甲装置中电解反应的总化学方程式是______.
(3)如果收集乙装置中产生的气体,两种气体的体积比是______.
(4)欲用丙装置精炼铜,G应该是______(填“纯铜”或“粗铜”),精炼液的成分是______.
(5)已知氢氧化铁胶体中含有带正电荷的红褐色的粒子,那么装置丁中的现象是______.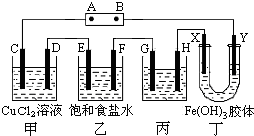
参考答案:(1)向乙中滴入酚酞试液,在F极附近显红色,说明该极上氢离子放电,所以该电极是阴极,所以E电极是阳极,D电极是阴极,C电极是阳极,G电极是阳极,H电极是阴极,X电极是阳极,Y是阴极,A是电源的正极,B是原电池的负极,故答案为:正极;
(2)电解氯化铜溶液时的阳极是氯离子放电,阴极是铜离子放电,所以电解反应为:CuCl2?电解?.?Cu+Cl2↑,故答案为:CuCl2?电解?.?Cu+Cl2↑;
(3)电解饱和食盐水的电解原理是:2NaCl+2H2O?电解?.?2NaOH+H2↑+Cl2↑,产生的氢气和氯气体积比实施1:1,故答案为:1:1;
(4)电解精炼铜时,粗铜作阳极,纯铜作阴极,含有铜离子的盐作电解质即可,故答案为:粗铜,硫酸铜溶液;
(5)根据异性电荷相吸的原理,氢氧化铁胶体中含有的带正电荷的粒子会向阴极即Y极移动,所以Y极附近红褐色变深,故答案为:Y极附近红褐色变深.
本题解析:
本题难度:一般
5、选择题 下列各装置中,能构成原电池的是
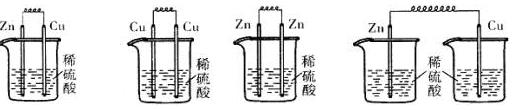
A B C D
参考答案:A
本题解析:略
本题难度:简单