微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 某化工厂为了综合利用废料?CaSO4,与相邻的合成氨厂设计了以下制备(NH4)2SO4?的工艺流程

请回答以下问题:
(1)沉淀池中发生的主要反应是(用化学方程式表示)______.
(2)从滤液中获取((NH4)2SO4晶体,必须的操作步骤是______(填写序号)
A.加热蒸干?B.蒸发浓缩?C.冷却结晶?D.过滤?E.萃取?F分液
(3)该生产过程中可以循环使用的X是______.
(4)在生产中,要检查输送氨气的管道是否漏气,可选用______(填写序号)
A.浓盐酸?B.湿润的蓝色石蕊试纸?C.湿润的淀粉碘化钾试纸?D.稀硫酸?E.湿润的红色石蕊试纸.
参考答案:(1)将NH3和CO2通入沉淀池中并加入CaSO4,生成(NH4)2SO4和CaCO3,发生CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4,
故答案为:CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4.
(2)从溶液中获取晶体应采取蒸发浓缩、冷却结晶、过滤等操作,所以必须操作步骤是BCD.
故答案为:BCD.
(3)由工艺流程可知,CaCO3在煅烧炉中分解生成CO2和CaO,CO2循环使用.
故答案为:CO2.
(4)A、浓盐酸挥发出的氯化氢与氨气生成氯化铵,有白烟产生,可以检验氨气,故A正确;
B、氨气遇湿润的蓝色石蕊试纸,无明显现象,不能检验氨气,故B错误;
C、氨气遇湿润的淀粉碘化钾试纸,无明显现象,不能检验氨气,故C错误;
D、氨气遇稀硫酸,无明显现象,不能检验氨气,故D错误;
E、氨气是碱性气体,能使湿润的红色石蕊试纸变蓝,可以检验氨气,故E正确.
故选:AE.
本题解析:
本题难度:一般
2、选择题 如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是
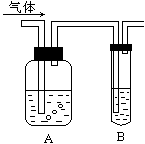
[? ]
气体?
A中试剂
B中试剂
A.
SO2、CO2
酸性KMnO4溶液
品红溶液
B.
Cl2、HCl?
浓硫酸
KI淀粉溶液
C.
NH3、CO2?
浓硫酸
酚酞试液
D.
C2H4、CH4?
酸性KMnO4溶液
溴的CCl4溶液
参考答案:B
本题解析:
本题难度:简单
3、简答题 某研究性学习小组用不纯的氧化铝(杂质为Fe2O3)为原料,设计了冶炼铝的以下工艺流程(部分反应产物没有标出):
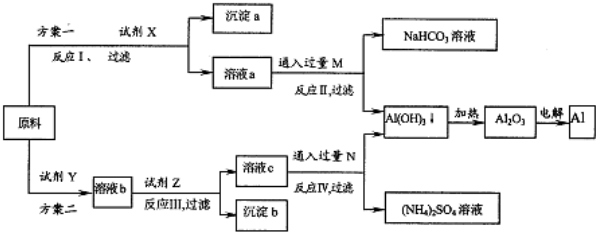
(1)试剂X的化学式为______,反应Ⅰ的离子方程式是______.实验室配置480mL?1mol?L-1?X的溶液必须用到玻璃仪器除烧杯、玻璃棒、试剂瓶、胶头滴管外,还有______.常用来可以标定所配X的溶液浓度是否准确的实验名称是______.
(2)按照方案设计,试剂Z的作用是调节溶液的pH,以生成沉淀b[Fe(OH)3].从试剂工业的角度,你认为方案______更合理,理由是______.
(3)已知N为氨气,实验室中还可以用下图装置制取氨气并进行氨气喷泉实验.
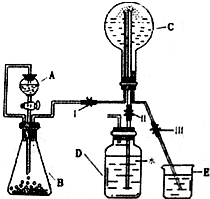
①仪器A的名称是______,装置中A口部和B口部之间联通导气管的作用是______.
②若用此装置制备N气,若A中盛有浓氨水,则B装置中的固体试剂不可以选用下列的______(填字母序号).
a.生石灰?b.烧碱?c.胆矾?d.碱石灰
(4)室温下,在a?mol?L-1的(NH4)2SO4水溶液中pH=5,存在着平衡NH4++H2O?NH3?H2O+H+,则该平衡常数的表达式为______(用含代数a的较为精确地数字表达式表示,不必化简,不做近似运算).
参考答案:(1)方案一:由溶液a通入过量的M生成氢氧化铝沉淀、碳酸氢钠可知,溶液a中含有偏铝酸根、气体M为二氧化碳,故试剂X为NaOH溶液,反应I为氧化铝与氢氧化钠溶液反应生成偏铝酸钠与水,离子方程式为:Al2O3+2OH-═2AlO2-+H2O,
实验室没有480mL容量瓶,应选择500mL容量瓶,配制500mL1mol?L-1?NaOH的溶液需要玻璃仪器有:烧杯、玻璃棒、试剂瓶、胶头滴管、500mL容量瓶,故缺少500mL容量瓶,
可以利用中和滴定方法以标定所配NaOH溶液浓度是否准确;
故答案为:NaOH;Al2O3+2OH-═2AlO2-+H2O;500mL容量瓶;中和滴定;
(2)方案二:由溶液c通入过量的N生成氢氧化铝沉淀、硫酸铵可知,溶液c中含有铝离子、N为氨气,故试剂Y为硫酸,溶液b中含有硫酸铝、硫酸铁,调节PH值,是铁离子转化为氢氧化铁,过滤后,再向滤液中加入过量的氨水沉淀铝离子,
与方案一相比较,方案一步骤少,操作简单,故方案一更合理,
故答案为:方案一;步骤少,操作简单;
(3)①、仪器A是分液漏斗,装置中A口部和B口部之间联通导气管的作用是:平衡分液漏斗内外压强,防止分液漏斗堵塞,
故答案为:分液漏斗;平衡内外压强,防止分液漏斗堵塞;
②、A中盛有浓氨水,与生石灰、烧碱、碱石灰混合,放出大量的热,溶液中氢氧根离子浓度增大,利用氨气逸出,产生大量的氨气,氨水与胆矾反应生成氢氧化铜沉淀,不能产生氨气,故c不能可以,
故答案为:c;
(4)室温下,在a?mol?L-1的(NH4)2SO4水溶液中pH=5,溶液中c(H+)=10-5mol/L,故溶液中c(OH-)=10-9mol/L,根据电荷守恒有:c(NH4+)+c(H+)=c(OH-)+2c(SO42-),即c(NH4+)+10-5mol/L=10-9mol/L+2amol/L,则c(NH4+)=(2a+10-9-10-5)mol/L,根据物料守恒计算溶液中c(NH3?H2O)=2amol/L-(2a+10-9-10-5)mol/L=(10-5-10-9)mol/L,故NH4++H2O?NH3?H2O+H+的平衡常数的表达式为10-5×(10-5-10-9)2a+10-9-10-5,
故答案为:10-5×(10-5-10-9)2a+10-9-10-5.
本题解析:
本题难度:一般
4、选择题 硫酸铵在强热条件下分解:4(NH4)2SO4=6NH3↑+N2↑+3SO2↑+SO3↑+7H2O若将生成的气体通入氯化钡溶液中,得到的沉淀物是
A.BaSO3和BaSO4
B.BaS
C.BaSO3
D.BaSO4
参考答案:A
本题解析:分析:根据反应生成的产物量和性质分析,二氧化硫溶于水和水反应生成亚硫酸,三氧化硫溶于水和水反应生成硫酸,氨气溶于水生成一水合氨;硫酸和氯化钡反应生成硫酸钡沉淀,亚硫酸和氨水反应生成亚硫酸铵,所以通入氯化钡溶液中,关键分解反应生成的气体物质的量进行计算分析判断;生成沉淀有亚硫酸钡和硫酸钡.
解答:反应后的混合气体通入到BaCL2溶液中发生的是复分解反应
?SO2+H2O+2NH3=(NH4)2SO3
(NH4)2SO3+BaCl2=BaSO3↓+2NH4Cl
SO3+H2O+2NH3 =(NH4)2SO4
(NH4)2SO4+BaCl2=BaSO4↓+2NH4Cl
依据反应定量关系,结合分解生成的气体物质的量可知,二氧化硫转化为亚硫酸铵,1mol三氧化硫转化为硫酸铵消耗氨气2mol,则4mol氨水和2mol二氧化硫反应生成亚硫酸铵,所以得到的沉淀为1mol硫酸钡,2mol亚硫酸钡,剩余二氧化硫和亚硫酸钡反应生成亚硫酸氢钡,最后得到沉淀为1mol硫酸钡,1mol亚硫酸钡,因此得到沉淀为BaSO3和BaSO4;
故选A.
点评:本题考查了物质反应的定量计算及物质性质的综合应用,关键是分析反应过程反应判断沉淀生成的实质,题目难度中等.
本题难度:简单
5、选择题 将足量NH3通入HNO3和AgNO3的混合溶液中,生成沉淀的物质的量(n)和通入NH3的体积(V)关系(如图所示)正确的是
[? ]
A.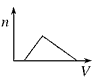
B.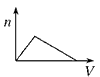
C.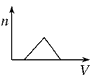
D.
参考答案:A
本题解析:
本题难度:简单