微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 【化学与技术】
下图表示某些化工生产的流程(有的反应条件和产物已略去)
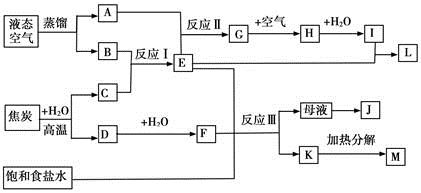
请回答下列问题:
(1)流程中所涉及的化学工业?(写出两个即可)。
(2)反应I需在500℃进行,主要原因是?;实际工业生产中,反应Ⅱ的条件是?。
(3)写出反应III的化学方程式?。
(4)工业上,析出K后,再向母液中继续通入E,并加入细小食盐颗料,其目的是?。
(5)工业上常用Na2CO3溶液吸收制取HNO3产生的尾气中的NO2,生成NaNO3、NaNO2和一种气体,写出反应的化学方程式?。
2、选择题 下列有关化学与生活的说法不正确的是
A.采用原煤脱硫技术,可减少燃煤产生的SO2

B.硅酸钠的水溶液俗称水玻璃,可用作木材防腐剂
C.水晶既不溶于水也不溶于任何酸
D.水泥、玻璃都是硅酸盐制品
3、实验题 (11分)钛是一种重要的金属,工业上用钛铁矿(主要成分为FeTiO3,含FeO、Al2O3、SiO2等杂质)为原料制钛白粉(TIO2 ) , TiO2常通过两种方法可制得 Ti。
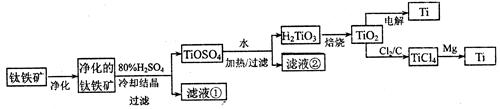
其中, 2H2SO4+ FeTiO3 = TiOSO4+ FeSO4+ 2H2O 。回答下列问题。
(l)净化钛矿石时,需用浓氢氧化钠溶液来处理,该过程中发生反应的化学方程式有:
SiO2+2NaOH =Na2SiO3 + H2O 和?
(2)滤液①中的溶质主要是 FeSO4,检验其中Fe2+的方法是:?.
(3)从 TiOSO4→H2TiO3需要加热,则加热的目的是:?。
(4)电解 TiO2来获得 Ti 是以 TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池。其阴极反应的电极反应式为:?.
(5)从化学平衡的角度解释:往TiO2和Cl2反应体系中加人焦炭后,能使反应 TIO2(s) + 2C12(g) TICl4(l) +O2(g)顺利进行的原因是:?
TICl4(l) +O2(g)顺利进行的原因是:?
4、实验题 (16分)已知A的产量通常用来衡量一个国家的石油化工水平,D的结构可用右下图模型表示。现以A为主要原料合成F和高分子化合物E,其合成路线如下图所示。
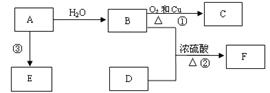

?
(1)A的结构式为 。 B中含官能团名称为?;
(2)写出反应的化学方程式

①:? 反应类型:?
②:? 反应类型:?
(3)实验室怎样鉴别B和D? ?
(4)在实验室里我们可以用如图所示的装置来制取F,乙中所盛的试剂为 ,该溶液的主要作用是?;该装置图中有一个明显的错误是?。
5、填空题 图1是氯碱工业中离子交换膜电解槽示意图,其中离子交换膜是“阳离子交换膜”,它有一特殊的性质——只允许阳离子通过而阻止阴离子和气体通过。
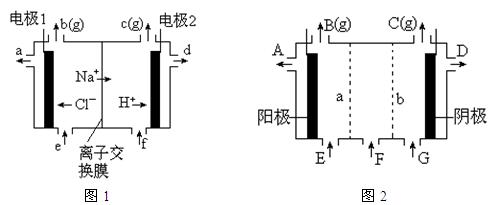
⑴、工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为?▲?,?▲?。
⑵、如果粗盐中SO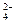 含量较高,必须添加钡式剂除去SO
含量较高,必须添加钡式剂除去SO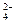 ,该钡试剂可以是?▲?。
,该钡试剂可以是?▲?。
A.Ba(OH)2?B.Ba(NO3)2?C.BaCl2?
⑶、为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为?▲?。
A.先加NaOH,后加Na2CO3,再加钡试剂?
B.先加NaOH,后加钡试剂,再加Na2CO3?
C.先加钡试剂,后加NaOH,再加Na2CO3
⑷、电解后得到的氢氧化钠溶液从?▲?口流出,b口排出的是?▲?气体,电极1应连接电源的
?▲?极(填“正”或“负”极);理论上讲,从f口加入纯水即可,但实际生产中,纯水中要加入一定量的NaOH溶液,其原因是?▲?。
⑸、图2是根据氯碱工业中离子交换膜技术原理,设计的电解Na2SO4溶液生产NaOH和H2SO4溶液的装置。请回答:
①、a为?▲?(填“阳”、“阴”)离子交换膜。
②、阳极的电极反应式是?▲?。
③、从D、E口流出或流进的物质的化学式分别为?▲?,?▲?。