微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)【化学—化学与技术】
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。

(1)工业上采用电解氧化铝和冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝:2Al2O3 4Al+3O2↑。
4Al+3O2↑。
加入冰晶石的作用为_______________________。
(2)上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为________,下列可作阴极材料的是______。
a.铝材 b.石墨 c.铅板 d.纯铝
(3)阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式_______________________。在铝阳极氧化过程中,需要不断地调整电压,理由是_________________。
(4)下列说法正确的是__________________。
a.阳极氧化是应用原电池原理进行金属材料表面处理的技术
b.铝的阳极氧化可增强铝表面的绝缘性能
c.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
d.铝的阳极氧化膜富多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
参考答案:(1)主要是降低Al2O3的熔化温度 (2分) (2)Al-3e-=Al3+(2分) d(2分) (3)2Al -6e-+3H2O=Al2O3+6H+(2分)铝阳极表面不断生成氧化物,电阻增大,为保持电流稳定,需不断增大电压(2分)(4)bd(2分)
本题解析:(1)Al2O3的熔点较高,为了降低能耗加入冰晶石作助熔剂,所以冰晶石的主要作用是降低Al2O3的熔化温度。(2)阳极发生氧化反应,活泼的金属先放电,Al 较活泼所以Al 先放电,电极反应为:Al-3e-=Al3+,由于该工艺是提纯Al,所以为了减少杂质物质阴极用纯铝,选d。(3)根据信息“阳极氧化能使金属表面生成致密的氧化膜”知道是Al 反应生成了Al2O3,则电极反应为:2Al -6e-+3H2O
本题难度:困难
2、填空题 (12分)6种相邻短周期主族元素的相对位置如下表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍。用化学用语回答下列问题:
(1)Y在周期表中的位置是________。
(2)X、Y、Z三种元素的原子半径由大到小的顺序是________。
(3)W、M、Q三种元素最高价氧化物对应的水化物中,酸性由强到弱的顺序是________。
(4)W的最高价氧化物可以和Z的氢化物反应,利用该反应可刻蚀玻璃,反应的化学方程式是________。
(5)X的含10个电子的气态氢化物甲是一种重要的化工原料。甲的电子式是 ,实验室制备甲的化学方程式是________,甲可以与X的最高价氧化物对应的水化物溶液反应生成盐乙,乙溶液中的离子浓度由大到小的顺序是 。X的含18个电子的气态氢化物丙可与空气构成一种环保型碱性燃料电池,电池工作时丙发生的电极反应方程式是 。
(6)工业上用下图所示装置电解Q元素的钠盐溶液丁,获得一种含Q元素的消毒剂。该反应的离子方程式是 。
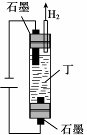
参考答案:(12分)
(1)二周期ⅥA族(1分)
(2)r(N)>r(O)>r(F)(1分)
(3)HClO4>H2SO4>H2SiO3(1分)
(4)SiO2+4HF===SiF4+2H2O(1分)
(5)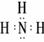 (1分),2NH4Cl+Ca(OH)2
(1分),2NH4Cl+Ca(OH)2  CaCl2+2NH3↑+2H2O(2分)
CaCl2+2NH3↑+2H2O(2分)
c(NO3-)>c(NH4+)>c(H+)>c(OH-)(1分)
N2H4-4e-+4OH-===N2+4H2O(2分)
(6)Cl-+H2O ClO-+H2↑(2分)
ClO-+H2↑(2分)
本题解析:X为氮,Y为氧,Z氟,W为硅,M为硫,Q为氯。(1)氧元素在第二周期ⅥA族。(2)同周期元素原子半径从左到右减小,所以半径顺序为:r(N)>r(O)>r(F)。(3)非金属性越强,其最高价氧化物对应的水化物酸性越强,同周期元素从左到右非金属性增强,所以酸性增强,顺序为:HClO4>H2SO4>H2SiO3。(4)二氧化硅和氢氟酸反应生成四氟化硅和水,方程式为:SiO2+4HF===SiF4+2H2O。(5)氮的氢化物为氨气,电子式为: ,实验室用氯化铵和氢氧化钙反应制取,方程式为:2NH4Cl+Ca(OH)2
,实验室用氯化铵和氢氧化钙反应制取,方程式为:2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O。氨气和硝酸反应生成硝酸铵,由于铵根离子水解,溶液显碱性,所以离子顺序为:c(NO3-)>c(NH4+)>c(H+)>c(OH-)。氮的18电子氢化物为N2H4,在原电池中失去电子生成无污染的氮气,电极反应为:N2H4-4e-+4OH-===N2+4H2O。(6)电解氯化钠溶液,由于生成的氯气和生成的氢氧化钠反应又生成了氯化钠和次氯酸钠,所以电解的结果为:Cl-+H2O
CaCl2+2NH3↑+2H2O。氨气和硝酸反应生成硝酸铵,由于铵根离子水解,溶液显碱性,所以离子顺序为:c(NO3-)>c(NH4+)>c(H+)>c(OH-)。氮的18电子氢化物为N2H4,在原电池中失去电子生成无污染的氮气,电极反应为:N2H4-4e-+4OH-===N2+4H2O。(6)电解氯化钠溶液,由于生成的氯气和生成的氢氧化钠反应又生成了氯化钠和次氯酸钠,所以电解的结果为:Cl-+H2O ClO-+H2↑。
ClO-+H2↑。
考点:元素周期表的推断,元素周期律,实验室制取氨气,电解原理的应用
本题难度:困难
3、填空题 亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。工业设计生产NaClO2的主要流程如下:

(1)A的化学式是 ,装置III中A在 极区产生。
(2)II中反应的离子方程式是 。
(3)通电电解前,检验III中阴离子的方法和步骤是 。
(4)为防止II中制备的NaClO2被还原成NaCl,应选合适的还原剂,除双氧水外,还可以选择的还原剂是 (填字母编号)。
a.Na2O2 b.FeCl2 c.Na2S
(5)常温时,HClO2的电离平衡常数Ka=1.07 10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中
10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中 = 。
= 。
(6)气体a、b与氢氧化钠溶液可构成燃料电池,用该电池电解200 mL 0.5 mol·L-1的CuSO4溶液,生成铜3.2 g,此时所得溶液中离子浓度由大到小的顺序是
参考答案:(1)H2SO4 (2分) 阳(2分)
(2)2ClO2+H2O2+2OH-=2ClO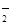 +O2↑+2H2O (3分)
+O2↑+2H2O (3分)
(3)取少量Ⅲ中溶液少许于试管中,先加入足量稀盐酸,无沉淀生成,再加入BaCl2溶
液,产生白色沉淀,证明含有SO42- (3分)
(4)a(2分)
(5)1.07×1010mol·L-1 (3分)
(6)c(H+)>c(SO42-)>c(Cu2+)>c(OH-) (3分)
本题解析:
(1)Ⅲ为电解硫酸钠溶液,本质是电解水,阴极2H++2e-=H2↑,阳极4OH--4e-=O2↑+2H2O,另一电极产生NaOH,因为该电解池为离子隔膜电解池,所以A为硫酸,在阳极区产生。
(2))Ⅱ中反应根据流程信息可知,生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,反应中ClO2是氧化剂,发生还原反应,HCl是还原剂,发生氧化反应,根据电子转移守恒可知4n(ClO2)=n(HCl),所以反应方程式为:2NaOH+2ClO2+H2O2=2 NaClO2+2H2O+O2↑,离子方程式是2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O。
(3)III中阴离子为SO42?,检验方法为:取少量Ⅲ中溶液少许于试管中,先加入足量稀盐酸,无沉淀生成,再加入BaCl2溶液,产生白色沉淀,证明含有SO42-
(4)加入FeCl2和Na2S会产生杂质,而Na2O2不会产生新的杂质,故a项正确。
(5)II中反应所得NaClO2溶液(含少量NaOH)的pH=13,可得c(H+)=1×10-13mol?L?1,则 =
= =1.07×1010mol·L-1 。
=1.07×1010mol·L-1 。
(6)电解硫酸铜溶液的化学方程式为:2CuSO4+2H2O 2H2SO4+2Cu+O2↑,生成铜3.2 g,则反应了CuSO4的物质的量为0.05mol,生成H2SO4的物质的量为0.05mol,则所得溶液含0.05mol的CuSO4和0.05mol的H2SO4,Cu2+水解生成H+,所以离子浓度由大到小的顺序为:c(H+)>c(SO42-)>c(Cu2+)>c(OH-)。
2H2SO4+2Cu+O2↑,生成铜3.2 g,则反应了CuSO4的物质的量为0.05mol,生成H2SO4的物质的量为0.05mol,则所得溶液含0.05mol的CuSO4和0.05mol的H2SO4,Cu2+水解生成H+,所以离子浓度由大到小的顺序为:c(H+)>c(SO42-)>c(Cu2+)>c(OH-)。
本题难度:一般
4、填空题 图为相互串联的甲、乙两电解池.试回答:

(1)若甲电解池利用电解原理在铁上镀银,则A是?(填电极材料),电极反应式?;B(要求同A)是?,电极反应式?;应选用的电解质溶液是?。
(2)乙电解池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈?,C极附近呈?。
(3)若甲电解池阴极增重4.32g,则乙槽中阳极上放出的气体在标准状况下的体积是?。
(4)若乙电解池中剩余溶液仍为400mL,则电解后所得溶液中新生成溶质的物质的量浓度为?mol?L-1,溶液的pH等于?。
参考答案:(1)铁、阴极,Ag++e-═Ag;银、阳极、Ag-e-═Ag+; 硝酸银溶液。
(2)红;浅黄绿
(3)448mL
(4)0.1mol/L;13
本题解析:(1)甲池是电镀池,铁作阴极,银作阳极,阴极上银离子得电子发生还原反应,电极反应式为Ag++e-═Ag,阳极上银失电子发生氧化反应,电极反应式为Ag-e-═Ag+,电解质溶液为可溶性的硝酸银溶液。
(2)乙是电解池,碳电极上氯离子放电生成氯气,铁电极上氢离子放电生成氢气,同时溶液中生成氢氧根离子,导致铁电极附近溶液呈碱性,酚酞试剂遇碱变红色,所以铁电极附近溶液变红色,碳电极上生成氯气,氯气是浅黄绿色气体,溶于水而使溶液呈浅黄绿色,所以C电极附近呈浅黄绿色。
(3)甲池中阴极上析出银,若甲电解池阴极增重4.32g,转移电子的物质的量=4.32g÷108g/mol=0.04mol,乙池中阳极上生成氯气,生成1mol氯气转移电子的物质的量是2mol,当转移0.04mol电子时生成氯气的物质的量为0.02mol,则氧气体积=0.02mol×22.4L/mol=0.224L=448mL。
(4)乙池中电池反应式为2NaCl+2H2O H2↑+Cl2↑+2NaOH,根据氯气和氢氧化钠的关系式知,生成0.02mol氯气时同时生成0.04mol氢氧化钠,则氢氧化钠的物质的量浓度=0.04mol÷0.4L=0.1mol/L,则溶液中氢离子浓度=10?14/0.1
H2↑+Cl2↑+2NaOH,根据氯气和氢氧化钠的关系式知,生成0.02mol氯气时同时生成0.04mol氢氧化钠,则氢氧化钠的物质的量浓度=0.04mol÷0.4L=0.1mol/L,则溶液中氢离子浓度=10?14/0.1
mol/L=10-13 mol/L,所以其pH=13。
本题难度:一般
5、选择题 用惰性电极电解2L饱和氯化钠溶液,经过一段时间以后,电解液的pH上升至13
(Kw=10-14),则电解过程中两极上共产生的气体在标准状况下体积为
A.2.24L
B.4.48L
C.1.12L
D.11.2L
参考答案:B
本题解析:溶液中pH=13,说明溶液中OH-的浓度是0.1mol/L,所以氢氧化钠的物质的量是0.2mol。则根据2NaCl+2H2O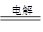 2NaOH+Cl2↑+H2↑可知,氢气和氯气的物质的量都是0.1mol,所以答案选B。
2NaOH+Cl2↑+H2↑可知,氢气和氯气的物质的量都是0.1mol,所以答案选B。
本题难度:一般