微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 根据如图装置判断下列说法中正确的是
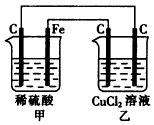
[? ]
A.甲池和乙池均为原电池装置
B.甲池铁棒上的电极反应式为Fe-3e-=Fe3+
C.乙池中与铁棒相连的碳棒上有Cl2生成
D.当甲池产生0.5 mol H2时,乙池中析出金属的物质的量也为0.5mol
参考答案:D
本题解析:
本题难度:一般
2、填空题 按右图装置实验,用惰性电极电解足量的NaOH溶液和足量CuSO4溶液.通电一段时间后,c极上有6.4gCu析出.
(1)电源P为______极;
(2)b极产生气体的体积为______L(标准状况);
(3)A烧杯溶液PH变化______(增大、减小或不变?)
(4)d极上所发生的电极反应式______,B烧杯总反应的化学方程式______.若要使B中溶液恢复电解前的状态,可向溶液中加入______(填写物质的化学式)______g.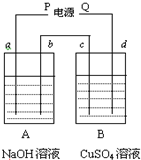
参考答案:(1)B杯中c质量增加,说明Cu沉积在c电极上,所以c是阴极,d是阳极,即Q为正极,P为负极,故答案为:负;
(2)P是负极,所以a是阴极,b是阳极,b极上的电极反应为:4OH--4e-=2H2O+O2↑,c极上的电极反应为:Cu2++2e-=Cu,整个电路是串联的,所以每个烧杯中的电极上转移电子数是相等的,据电极反应:Cu2++2e-=Cu,可知c极上有6.4gCu析出,转移0.2mol电子,当转移0.2mol电子时,b极上生成氧气的物质的量为0.05mol,体积为0.05mol×22.4L/mol=1.12L.故答案为:1.12;
(3)A烧杯溶液电解的实质是电解水,所以氢氧化钠溶度增大,PH变大,故答案为:增大;
(4)d是阳极,电解硫酸铜时,在阳极上是氢氧根离子放电,电极反应式为:4OH--4e-=2H2O+O2↑,总的电解原理方程式为:2CuSO4+2H2O?通电?.?2Cu+O2↑+2H2SO4,根据电解质复原出什么加什么的原则,则需要接入氧化铜或是碳酸铜,知c极上有6.4gCu析出时,即0.1mol铜析出时,要加入氧化铜或是碳酸铜均是0.1mol,质量分别是8g和12.4g,
故答案为:4OH--4e-=2H2O+O2↑;2CuSO4+2H2O?通电?.?2Cu+O2↑+2H2SO4;CuO?(或CuCO3);?8(或12.4).
本题解析:
本题难度:一般
3、选择题 关于下列各装置图的叙述中,不正确的是

[? ]
A.装置①中,C为阳极,d为阴极
B.装置②可用于排空气法收集H2、NH3、Cl2、HCl、NO等
C.装置③中x为四氯化碳,可用于吸收氨气或氯化氢
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
参考答案:B
本题解析:
本题难度:简单
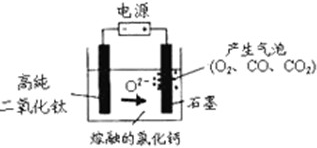
4、选择题 如图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛.下列说法中正确的是( )
A.阳极的电极反应式为:2Cl-→Cl2↑+2e-
B.阴极的电极反应式为:TiO2+4e-→Ti+2O2-
C.通电后,O2-、Cl-均向阴极移动
D.石墨电极的质量不发生变化
 VO2++2H+,错误;C、放电时为原电池,a电极为正极,b电极为负极,溶液中阳离子向正极移动,H+从右槽迁移进左槽,错误;D、放电时为原电池,a电极为正极,发生还原反应,电极反应式为VO2++2H++e- = VO2++H2O,左槽溶液颜色由黄色变为蓝色,正确。
VO2++2H+,错误;C、放电时为原电池,a电极为正极,b电极为负极,溶液中阳离子向正极移动,H+从右槽迁移进左槽,错误;D、放电时为原电池,a电极为正极,发生还原反应,电极反应式为VO2++2H++e- = VO2++H2O,左槽溶液颜色由黄色变为蓝色,正确。