微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 X元素的阳离子和Y元素的阴离子具有与氖原子相同的电子层结构,下列说法正确的是
A.原子序数X<Y
B.原子半径X>Y
C.原子的最外层电子数X>Y
D.元素的最高正价X<Y
参考答案:B
本题解析:X元素的阳离子和Y元素的阴离子具有与氖原子相同的电子层结构,则X一定是第三周期的金属元素,Y一定是第二周期的非金属元素,所以原子序数是X>,原子半径X>Y,最外层电子数是X<Y,但元素的最高正价不一定是X<Y,例如F没有正价,所以正确的答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题。试题在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑推理能力,易错点是学习D。
本题难度:一般
2、填空题 下图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格: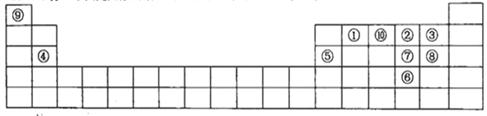
(1)在这10种元素中,非金属性最强的是?(填序号);
(2)元素②⑧⑨以原子个数比1:1:1形成的化合物的结构式为?,元素②与⑨形成的18e-化合物的电子式?;
(3)②⑨⑩三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M中含有的化学键类型有?;
(4)比较元素⑦⑧形成的气态氢化物的稳定性:?>?(用化学式表示)
(5)元素⑤的氧化物与氢氧化钠溶液反应的离子方程式?。
(6)元素④和③形成的化合物属于?化合物,用电子式表示其形成过程?。
参考答案:(1)③;(2)H—O—Cl;?H∶O∶O∶H?;(3)离子键和共价键
(4)HCl> H2S。(5)Al2O3+2OH-=2AlO2-+H2O (6)离子 电子式形成过程
本题解析:(1)在同一周期的元素中,元素的原子序数越大,元素的非金属性越强,在不同周期的元素中,元素的原子核外的电子层数越少,元素的非金属性越强。因此在这些元素中非金属性最强的是③F元素。(2)元素O、Cl、H三元素以原子个数比1:1:1形成的化合物HClO的结构式为H—O—Cl。元素O、H形成的18e-化合物H2O2的电子式为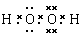 。(3)H、N、O三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M为NH4NO3。该化合物为在化合物,其中含有的化学键类型有离子键、共价键。(4)S、Cl是同一周期的元素。元素的元素半径越小,元素得到电子的能力就越强,元素的非金属性就越强。元素结合H形成的氢化物的稳定性就越强。所以稳定性HCl>H2S。(5)元素⑤是Al,其氧化物Al2O3是两性氧化物,既能与强酸反应液能与强碱发生反应。生成盐和水。Al2O3与NaOH溶液反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O。(6)④元素Mg和③元素F形成的化合物MgF2属于离子化合物,用电子式表示其形成过程为:
。(3)H、N、O三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M为NH4NO3。该化合物为在化合物,其中含有的化学键类型有离子键、共价键。(4)S、Cl是同一周期的元素。元素的元素半径越小,元素得到电子的能力就越强,元素的非金属性就越强。元素结合H形成的氢化物的稳定性就越强。所以稳定性HCl>H2S。(5)元素⑤是Al,其氧化物Al2O3是两性氧化物,既能与强酸反应液能与强碱发生反应。生成盐和水。Al2O3与NaOH溶液反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O。(6)④元素Mg和③元素F形成的化合物MgF2属于离子化合物,用电子式表示其形成过程为: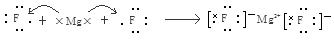 。
。
本题难度:一般
3、选择题 若元素X、Y是短周期元素,两者能形成化合物X2Y3,已知X的原子序数为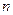 ,则Y的原子序数不可能是( )
,则Y的原子序数不可能是( )
A.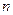 +11
+11
B.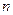 -6
-6
C.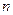 +3
+3
D.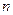 -5
-5
参考答案:
B
本题解析:
化合物的化学式为X2Y3,即X为+3价,Y为-2价,由于两元素的化合价一个为偶数,一个为奇数,所以其对应的族序数也应为一个偶数族,一个奇数族。利用奇偶法,族序数差不可能为偶数,也可判断出只有B不可能。
本题难度:一般
4、填空题 (9分)下表是元素周期表的一部分,请依据该表回答问题。
族
周期
| IA
| ?
| 0
|
1
| H
| IIA
| IIIA
| IVA
| VA
| VIA
| VIIA
| He
|
2
| Li
| Be
| B
| C
| N
| O
| F
| Ne
|
3
| Na
| Mg
| Al
| Si
| P
| S
| Cl
| Ar
|
?
(1)下列说法正确的是?
A.可用于半导体材料的元素是碳
B.PH3的稳定性比H2S强
C.第VA族元素的最高价氧化物对应的水化物化学式均为H3RO4
D.H2SiO3的酸性比H3PO4弱