微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 现有如下三个热化学方程式:
(1)H2(g)+O2(g)===H2O(g),△H=a kJ·mol-1
(2)H2(g)+O2(g)===H2O(l),△H=b kJ·mol-1
(3)2H2(g)+ O2(g)===2H2O(l),△H=c 91eXAm.orgkJ·mol-1
下列关于它们的表述正确的是
[? ]
A.它们都是吸热反应
B.a.b.c均为正值
C.a=b
D.2b=c
参考答案:D
本题解析:
本题难度:一般
2、填空题 (14分)工业上以粗食盐(含有少量Ca2+、Mg2+杂质)、氨、石灰石等为原料,可以制备Na2CO3。其过程如下图所示。
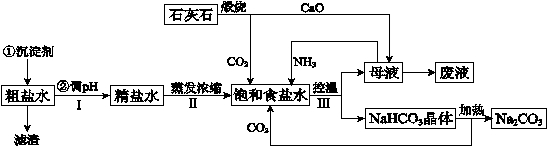
请回答:
(1)在处理粗盐水的过程中,可加入石灰乳和纯碱作为沉淀剂,则所得滤渣的成分除过量的沉淀剂外还有 。
(2)将CaO投入含有大量的NH4Cl的母液中,能生成可循环使用的NH3,该反应的化学方程式是 。
(3)向饱和食盐水中首先通入的气体是 ,过程Ⅲ中生成NaHCO3晶体的反应的化学方程式是 。
(4)碳酸钠晶体失水的能量变化示意图如下:

Na2CO3·H2O (s) 脱水反应的热化学方程式是 。
(5)产品纯碱中常含有NaCl。取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体。则该产品中Na2CO3的质量分数是 。
(6)熔融Na2CO3可作甲烷——空气燃料电池的电解质,该电池负极的反应式是 。
参考答案:(14分,每空2分)
(1)CaCO3、Mg(OH)2(漏写得1分,错答得0分)
(2)2NH4Cl+CaO=CaCl2+2NH3↑+2H2O
(3)NH3 ; NH3+H2O+CO2+NaCl =NaHCO3↓+NH4Cl
(4)Na2CO3·H2O(s)= Na2CO3(s) +H2O(g) ΔH=" +" 58.73 kJ·mol-1
(5)106(b-a)/11a
(6)CH4-8e-+4CO32-=5CO2+2H2O
本题解析:(1)粗盐中的钙、镁离子可与石灰乳和纯碱反应生成碳酸钙和氢氧化镁沉淀,所以滤渣的成分除过量的沉淀剂外还有CaCO3、Mg(OH)2;
(2)CaO投入水中生成氢氧化钙,与氯化铵反应产生氨气、氯化钙、水,所以该反应的化学方程式是2NH4Cl+CaO=CaCl2+2NH3↑+2H2O;
(3)因为二氧化碳在水中的溶解度不大,所以先通入氨气,增大溶液的碱性,再通入二氧化碳气体;氨气、二氧化碳与饱和食盐水反应生成氯化铵和碳酸氢钠沉淀,化学方程式是NH3+H2O+CO2+NaCl =NaHCO3↓+NH4Cl;
(4)根据碳酸钠晶体失水的能量变化示意图可知,Na2CO3·10H2O(s)= Na2CO3(s) +10H2O(g) ΔH=+532.36kJ/mol,Na2CO3·10H2O(s)= Na2CO3·H2O (s) +9H2O(g) ΔH=+473.63kJ/mol,根据盖斯定律,两式相减Na2CO3·H2O (s) 脱水反应的热化学方程式是Na2CO3·H2O(s)= Na2CO3(s) +H2O(g) ΔH=+532.36kJ/mol-(+473.63kJ/mol)="+" 58.73 kJ·mol-1;
(5)碳酸钠与盐酸反应生成硫酸钠、水和二氧化碳,加热蒸干后得到的固体为氯化钠,发生反应的化学方程式是,Na2CO3+2HCl=2NaCl+CO2↑+H2O,利用差量法,设样品中碳酸钠的质量是x,则
Na2CO3+2HCl=2NaCl+ CO2↑+ H2O 固体质量差
106 117 117-106=11
x (b-a)g
所以106:11=x:(b-a)g,解得x=106(b-a)/11g,则该产品中Na2CO3的质量分数是106(b-a)/11g/ag=106(b-a)/11a;
(6)用熔融碳酸钠作电解质,甲烷燃料电池中,负极发生氧化反应,则甲烷在负极发生氧化反应,失去电子,生成二氧化碳和水,所以负极的电极反应式是CH4-8e-+4CO32-=5CO2+2H2O。
考点:考查联合制碱法的工艺流程,盖斯定律的应用,电化学反应原理的应用
本题难度:困难
3、选择题 下列有关热化学方程式的表示及说法正确的是( )
A.已知c(石墨,s)=c(金刚石,s)△H>0,则金刚石比石墨稳定
B.已知H2(g)+F2(g)═2HF(g)△H=-270kJ/mol,则2L氟化氢气体分解成1L氢气和1L氟气吸收270kJ热量
C.HCl和NaOH反应的中和热为-57.3kJ/mol,则H2SO4和Ba(oH)2反应的中和热△H=2×(-57.3)kJ/mol
D.已知I2(g)+H2(g)═2HI(g)△H1;I2(s)+H2(g)═2HI(g)△H2;则△H1<△H2
参考答案:D
本题解析:
本题难度:一般
4、选择题 在密闭容器中充入4mol SO2和3mol O2,在一定条件下建立平衡:2SO2(g)+O2(g)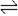 2SO3(g) △H。测得SO2的转化率为90%,则在此条件下,反应放出的热量为 ( )
2SO3(g) △H。测得SO2的转化率为90%,则在此条件下,反应放出的热量为 ( )
A.1.8△H
B.2△H
C.△H
D.0.9△H