微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如图,曲线表示原子序数在前20号中的某些连续的主族元素单质沸点的变化规律 (原子序数按递增顺序连续排列),其中A点表示的元素是
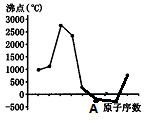 ?
?
A.S
B.Al
C.Cl
D.Si
参考答案:C
本题解析:A电对应的沸点低于0℃,即该单质在常温下是气体,所以答案选C。
本题难度:一般
2、选择题 若aAm+与bBn-的核外电子排布相同,则下列关系不正确的是?
A.b=a-n-m
B.离子半径Am+<Bn-
C.原子半径A<B
D.A的原子序数比B大(m+n)
参考答案:C
本题解析:因为aAm+与bBn-的核外电子排布相同,所以 a-m=b+n,所以A对,a>b,D对,当核外电子排布相同的微粒,质子数越大,半径越小B对,A、B元素在不同的周期,A在下一周期,原子半径A<B
本题难度:一般
3、填空题 (1)(8分)有几种元素的微粒电子层结构如图  所示,其中:?
所示,其中:?
①某电中性微粒一般不和其他元素的原子反应,这种微粒符号是______?__。
②某微粒的盐溶液,加入AgNO3溶液时会出现白色浑浊,这种微粒的电子式是______?。
③某微粒氧化性甚弱,但得到电子后还原性强且这种原子最外层有一个电子,这种微粒符号是__。
④某微粒具有还原性,且这种微粒失去2个电子即变为原子,这种微粒的符号是__?
(2)(8分)11—18号元素中,其单质相互化合能形成?种离子化合物,最高价氧化物对应水化物酸性最强的元素是?;最高价氧化物对应水化物碱性最强的物质的化学式为?;气态氢化物稳定性最强的物质的电子式是________。
参考答案:(1)①Ar?(2分)?②(略) (2分)③ K+(2分)?④S2-(2分)
(2) 4 ; CI(或氯);NaOH(写名称不得分)? (HCl电子式略)
本题解析:(1)①呈电中性,则x=2+8+8=18,故为Ar;
..
②白色沉淀为氯化银,故电子式为:[:Cl:]-;
..
③这种原子的核外电子排布为:2 8 8 1,该离子为K+,其核外电子排布为:2 8 8;
④S2-的核外电子排布为:2 8 8,失去2个电子后变为硫原子,其其核外电子排布为:2 8 6;
(2)单质相互化合能形成NaCl、Na2S、MgCl2、MgS,共4种离子化合物;
同周期,越往右,最高价氧化物对应水化物酸性越强,越往左,最高价氧化物对应水化物碱性越强(惰性气体元素不考虑);
同周期,由左到右,原子的得电子能力逐渐增强,则气态氢化物的稳定性增强,所以气态氢
..
化物稳定性最强的物质是HCl,其电子式为? H:Cl:
本题难度:简单
4、选择题 下列叙述中,正确的是
A.同周期元素中,ⅦA族元素的原子半径最大
B.ⅥA族元素的原子,其半径越大,越容易得到电子
C.室温时,0族元素的单质都是气体
D.元素周期表中,从ⅢB到ⅡB这10个纵行的元素都是副族元素
参考答案:C
本题解析:同周期自左向右,原子半径逐渐减小,则同周期元素中,IA族元素的原子半径最大,选项A不正确;同主族自上而下,原子半径逐渐增大,非金属性逐渐减弱,因此ⅥA族元素的原子,其半径越大,越难得到电子,选项B正确;室温下稀有气体单质都是气体,选项C正确;元素周期表中,从ⅢB到ⅡB这10个纵行的元素都是金属元素,包括7个副族和1个第Ⅷ族,选项D不正确,答案选C。
点评:该题是中等难度的试题,主要是考查学生对元素周期表结构,以及灵活运用元素周期律解决实际问题的能力的培养,有利于培养学生的逻辑思维能力和灵活应变能力。熟练记住元素周期表的结构和元素周期律,是答题的关键。
本题难度:简单
5、选择题 下表是元素周期表的一部分,下列有关说法正确的是

A.a、b两元素的单质构成原电池两极时,a—定为负极
B.e的氢化物分子和d的氢化物分子不可能含有相同的电子数
C.六种元素中,c元素与其它三种非金属元素均能形成化合物
D.c、e、f的含氧酸的酸性依次增强
参考答案:C
本题解析:根据元素在周期表中的位置,可以确定a为Mg,b为Al,c为C,d为O,e为S,f为Cl。Mg、Al构成原电池时,弱电解质为NaOH,则Al为负极,A错;H2S和H2O2分子所含电子数相同,B错;C可以和O、S、Cl形成化合物CO2、CS2、CCl4等,C正确;C、S、Cl的最高价含氧酸酸性依次增强,如非最高价含氧酸则不一定,如HClO是弱酸,D错。
本题难度:一般