微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 X、Y、Z、W是原子序数依次增大的短周期主族元素,X与Z同主族,X原子的最外层电子数是其最内层电子数的2倍,Y原子的最外层电子数比W原子的少2个。下列叙述一定正确的是
A.X、Y的单质均可以导电
B.原子半径:Z>W
C.X、Z的氧化物均为酸性氧化物
D.Y、W的最高价氧化物的水化物均易溶于水
参考答案:B
本题解析: X最外层电子数是内层电子数的2倍可推出X为C,X与Z同主族可推出Z为Si,W比Y多2个电子,可推出W为P、Y为Al。
A、铝能导电、碳元素形成的单质石墨可以导电,金刚石和C60不能导电,错误;B、同周期从左向右,原子半径减小,原子半径:Si>P,正确;C、二氧化硅、二氧化碳是酸性氧化物,CO是不成盐氧化物,错误;D、氢氧化铝和硅酸均不溶于水,错误。
本题难度:一般
2、选择题 下列非金属元素,其气态氢化物最稳定的是
A.构成矿物和岩石的主要元素
B.地壳中含量最多的元素
C.空气中含量最多的元素
D.构成化合物种类最多的元素
参考答案:B
本题解析:略
本题难度:简单
3、选择题 下列四种化学操作名称从左到右分别是

A.过滤、蒸发、蒸馏、萃取分液
B.过滤、蒸馏、蒸发、萃取分液
C.蒸发、蒸馏、过滤、萃取分液
D.萃取、蒸馏、蒸发、过滤分液
参考答案:A
本题解析:试题分析:A为过滤装置、B为蒸发装置、C为蒸馏装置、D为分液装置。
考点:化学实验
点评:分离不溶性固体与液体用A、分离互溶的液体用C、分离互不相溶的液体用D。
本题难度:简单
4、推断题 已知X、Y、Z、M、W、R是前四周期中的六种元素。X元素原子形成的离子是一个质子,Y原子的价电子构型为2s22p2,Z的单质在常温下是无色气体且Z原子的单电子个数是同周期元素原子中最多的。
(1) 24R原子最外层的电子排布图是?,ZO3-的空间构型是?;
(2) Z、M、W原子序数依次增大,三种元素的第一电离能由大到小的顺序是?;Y、Z、W三种元素的电负性由大到小的顺序是?。(填元素符号)
(3) Ne与Wn-的电子数相同,W所在族的各元素的氢化物的水溶液均显酸性,则该族元素的氢化物中沸点最低的是?。(填化学式)
(4)ZX4W在物质中,各种粒子间的相互作用力包括?。(填字母编号)
A.非极性共价键
B.极性共价键
C.配位键
D.离子键 E.氢键
参考答案:(1)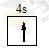 ?平面三角形?(2)F>N>O? F>N>C(3)HCl(4)BCD
?平面三角形?(2)F>N>O? F>N>C(3)HCl(4)BCD
本题解析: 质子为H+,X是H;由Y的价电子排布式得Y是C;Z单质是无色气体且Z原子单电子个数同周期原子中最多可推出Z为N。
(1)R原子序数为24,R为Cr,价电子排布式为3d54s1,最外层只有1个电子。NO3-中N价层电子对数= 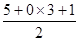 =3,N周围有3对电子对,无孤对电子,NO3-为平面三角形。
=3,N周围有3对电子对,无孤对电子,NO3-为平面三角形。
(2)Z、M、W原子序数依次增大,所以Z、M、W分别为N、O、F。同周期元素从左向右,第一电离能总体趋势增大,IIA和VA反常,第一电离能:F>N>O;同周期元素(0族元素除外)从左向右,电负性增大,电负性:F>N>C。
(3)同族元素氢化物水溶液均呈酸性的是VIIA族,因HF存在分子间氢键,沸点反常地高,沸点:HF>HI>HBr>HCl。
(4)NH4F中NH4+与F-以离子键结合;NH4+中,三个H与N形成共价键,一个H与N形成配位键。
本题难度:一般
5、选择题 下列说法正确的是?
A.在周期表中,族序数都等于该元素的最外层电子数.
B.非金属性最强的元素,其氢化物溶于水的酸性最强
C.碱金属随原子序数增大,熔点降低;卤族元素的单质,随原子序数增大,熔点依次升高.
D.同一周期的主族元素,从左至右,原子半径减小,它们所形成的简单离子半径从左至右依次增大
参考答案:C
本题解析:
主族序数等于该元素的最外层电子数,副族和零族例外,例如,铁原子最外层只有2个电子,但它位于第VIII族,A选项错误;非金属性最强的元素是氟,氟化氢是弱酸,B选项错误;碱金属固态单质为金属晶体,随原子序数增大,金属键减弱,晶体熔点降低;卤素单质是分子晶体,随着相对分子质量增大,分子间作用力增大,熔点升高,C选项正确;同一周期的主族元素,从左至右,简单阳离子半径逐渐减小,而简单阴离子半径比对应的原子半径要大。例如,S2->Cl->Na+>Mg2+>Al3+,D选项错误。
本题难度:一般